点击上方的 行舟Drug ▲ 添加关注
【概述】本指导原则所述的弹性体密封件主要指药品包装系统中直接接触药品的橡胶密封件、热塑性弹性体(thermoplasticelastomer,TPE)密封件(以下简称密封件)。作为药品包装组件,密封件一方面应满足包装系统对密封性的要求,为药品提供保护并符合包装预期的使用功能;另一方面还应与药品具有良好的相容性,即不可引入存在安全性风险的浸出物,或浸出物水平符合安全性要求;且不会因为吸附药品中的有效成分或功能性辅料,影响药品的质量、疗效和安全性。


【密封件】
密封件的分类及用途
(1)橡胶类密封件橡胶由生胶制备,生胶是一类线型柔性高分子聚合物;其分子链柔性好,经硫化后形成网状结构,在外力的作用下可产生较大形变,除去外力后能迅速恢复原状;橡胶的特点是在很宽的温度范围内具有优异的弹性,所以又称弹性体;由于成型时发生不可逆的交联反应,橡胶也被称为热固性弹性体。
药品包装常用的橡胶材料主要有:聚异戊二烯橡胶、丁基橡胶、卤化(氯化/溴化)丁基橡胶、硅橡胶、三元乙丙橡胶等。按照橡胶组件的结构,可分为有隔层密封件、无隔层密封件;按照加工工艺,可分为覆膜工艺、涂膜工艺和镀膜工艺等
(2)热塑性弹性体密封件
热塑性弹性体是具有类似于橡胶特性的热塑性材料,在常温下显示橡胶的高弹性,在高温下又能塑化成型的高分子材料。热塑性弹性体按照制备方法分为共聚型(化学合成型)热塑性弹性体和共混型(橡胶共混型)热塑性弹性体。按照化学结构可分为苯乙烯系嵌段共聚类(styreneicblockco-polymers,SBC)、聚氨酯类(thermoplastic polyurethanes,TPU )、聚酯类(thermoplasticpolyethyleneelastomer,TPEE)和聚烯烃类(thermoplasticpoly-olefin,TPO)等。TPU、TPEE、TPO等,在医疗器械领域广泛应用。目前用于药品密封件的热塑性弹性体主要是以苯乙烯嵌段聚合物为主的共混体系、高分子弹性体和塑料通过动态硫化的共混体系。

(3)药品包装用密封件按照药品的剂型及给药途径,密封件可分为:注射剂用密封件、吸入制剂用密封件、液体(口服/外用)制剂用密封件,其他制剂用密封件等。
注射剂用密封件有:注射液用卤化(氯化/溴化)丁基橡胶塞,注射用无菌粉末用卤化(氯化/溴化)丁基橡胶塞,注射用冷冻干燥用卤化(氯化/溴化)丁基橡胶塞,药用合成聚异戊二烯垫片,预灌封注射器用氯(溴)化丁基橡胶活塞,预灌封注射器用聚异戊二烯橡胶针头护帽,笔式注射器用氯(溴)化丁基橡胶活塞和垫片等。
吸入制剂用密封件如气雾剂阀的内、外密封圈,其材料主要为三元乙丙橡胶(ethylene有propylenedienemonomer,EPDM)和热塑性弹性体密封圈。
其他液体制剂用密封件有硅橡胶垫片等。

2 密封件配合(方)与加工工艺
(1)橡胶密封件通常情况下,橡胶密封件生产企业根据成品的性能要求,考虑加工工艺等因素,选择确定橡胶材料和各种配合剂的类型及其用量。
①配合体系。一个完整的橡胶配合体系包括生胶体系、硫化体系、补强填充体系、软化体系、防老体系、着色体系。
a.生胶体系:称之为母体材料或基体材料;是用化学合成的方法制得的未经过任何加工的高分子材料。如异戊二烯橡胶、丁基橡胶、卤化(氯化/溴化)丁基橡胶、乙丙橡胶等。
b.硫化体系:其与橡胶大分子起化学作用,使橡胶线型大分子交联形成空网状结构,提高橡胶的性能及稳定形态。硫化体系包括硫化剂、硫化促进剂和硫化活性剂。
•硫化剂。是指在一定条件下能使橡胶发生交联的物质。目前常用的硫化剂有硫黄、含硫化合物、过氧化物、酚醛树脂和金属化合物等。
•硫化促进剂:是指能加快硫化速率、缩短硫化时间的物质,简称促进剂。使用促进剂可减少硫化剂的用量,或降低硫化温度,并可提高硫化胶的物理机械性能。
•硫化活性剂:是指能增加促进剂活性,从而减少促进剂用量或缩短硫化时间,改善硫化胶性能的物质,简称活性剂。活性剂多为金属氧化物,常用的有氧化锌、氧化镁等。

c.补强填充体系:包括补强剂和填充剂,它们可以提高橡胶的力学性能,改善加工工艺性能。补强剂是指可提高橡胶物理机械性能的物质,常用的补强剂有天然气炭黑、白炭黑(二氧化硅)和其他矿物填料;填充剂是指在胶料中起增加容积作用的物质,常用的填充剂有碳酸钙、煅烧高岭土(水合硅酸铝)、滑石粉(硅酸镁)等。
d.软化体系:是一类分子量较低的化合物,其能够降低橡胶制品的硬度和混炼胶的黏度,改善加工工艺性能。常用的有药用凡士林、低分子聚乙烯(如聚乙烯蜡)等。
e.防老体系:是指能防止和延缓橡胶老化,提高橡胶制品使用寿命的化学物质;也称为防老剂。主要有酚类1010、1076等。
f.着色体系:主要是为了调整橡胶制品的标识色,常用的着色剂有氧化铁(红色)、钛白粉(白色)、天然气炭黑(灰色)等。
②加工工艺:橡胶密封件的制备过程一般包括混炼、压延或压出、硫化、冲切、清洗、包装等工序。 a.混炼:是指将各种配合剂混入生胶中制成质量均匀的混炼胶的工艺过程。
b.压延:是指利用压延机辊筒之间的挤压力作用,使混炼胶发生塑性流动变形,最终制成具有一定断面尺寸和几何形状的片状材料的工艺过程。
c.压出:是指混炼胶在压出机机筒和螺杆间的挤压作用下,连续地通过一定形状的口型,制成各种复杂断面形状的半成品的工艺过程。
d.硫化:是橡胶密封件的成型工序,是指混炼胶在一定的压力和温度下,橡胶大分子由线型结构变成网状结构的交联过程。硫化后的橡胶由塑性的混炼胶转变为高弹性的交联橡胶,从而获得更完善的物理机械性能和化学性能。硫化方法主要有注射模压工艺和常规模压工艺。
e.冲切:将硫化好的成片橡胶密封件用冲切设备冲成单只产品
f.清洗:使用纯化水或注射用水对橡胶密封件进行清洗、硅化,然后干燥(灭菌);清洗后会加入适量二甲硅油(以下简称硅油)硅化,使橡胶密封件滑爽、走机顺畅。
g.包装:在C+A洁净区域,用双层塑料洁净袋包装(免清洗橡胶塞应使用无菌袋),然后移到外包装间纸箱封装。

药品与密封件发生相容性风险分级
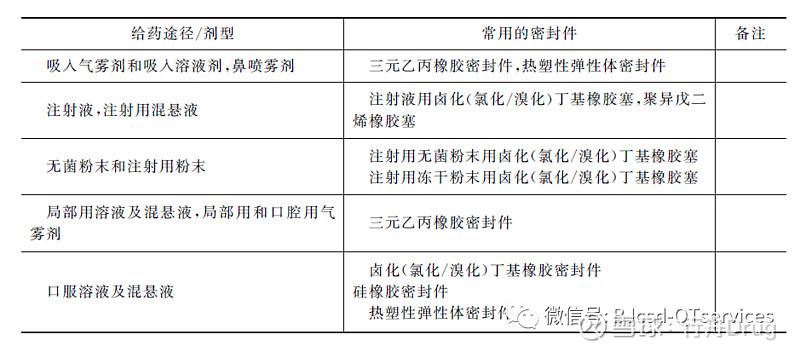
根据药品的剂型、临床给药途径,制剂处方的物理形态与理化性质,以及与所用包装密封件发生相互作用的可能性,可将药品的使用风险分为最高风险(直接接触人体组织或进入血液系统)、高风险和低风险几个等级。可将药品与包装密封件发生相互作用的可能性分为高风险(液体制剂)、中等风险和低风险几个等级。实际应用和相关研究表明,吸入气雾剂、喷雾剂及溶液剂,注射液与包装密封件发生相互作用的概率更高,风险更大。因此,对吸入制剂、注射液,特别要注意进行药品与包装密封件的相容性研究。对其他液体制剂,可在进行相关风险分析评估的基础上,酌情进行与包装密封件的相容性研究。表1列出了不同给药途径药品的风险分级及其与包装组件发生相互作用的可能性。表2列出了不同剂型药品常用的密封件。
表1
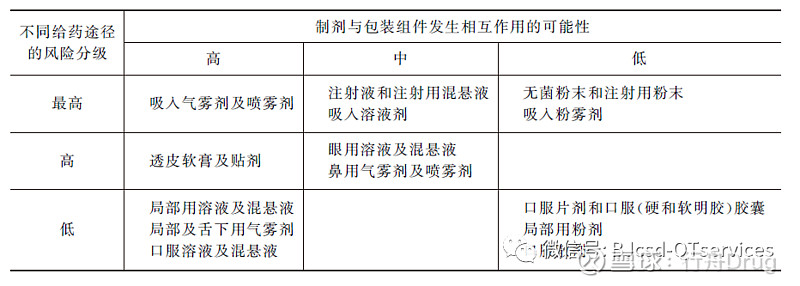
表2

相容性研究的考虑要点
密封件在选择和使用时,应具备如下特性:保护性、安全性、相容性与功能性。安全性除包括所用密封件材料和制造过程中引入的物质符合安全性要求外,还包括其应与所包装药品具有相容性。相容性研究是证明在药品生产、放置及使用过程中密封件与药品之间没有发生严重的相互作用,并导致药品有效性和稳定性发生改变,或者产生安全性风险的过程。

.1药品与密封件的相互作用
药品与密封件长期接触后,可能会发生密封件组分(和/或组分的降解产物)向药品中迁移,以及密封件对药品处方中组分的吸附,并发生进一步的物理和/或化学反应。发生迁移所致的可能反应包括:密封件中某些具有化学活性的低分子有机物,如硫化体系中的添加物等迁移进入药品中,可催化或与药品成分发生化学反应,导致药品颜色加深、产生沉淀、出现可见异物,活性成分降解速度加快等;密封件中某些非化学活性的低分子有机物,如表面硅油等迁移进入药品中,造成不溶性微粒增多,并可能絮凝成线状物,造成可见异物超标;密封件无机填料引入的元素或离子(如Mg、Zn、Al、Si;及有害的Pb、As、Cd、Co、Sb等)会迁移到药品中,导致某些药物产生沉淀,或产生潜在的安全性风险等;密封件中某些具有生物毒性的有机物,会导致潜在生物学反应,影响密封件的溶血性能,或导致细胞毒性超标等。另外,因可能存在容易被橡胶吸附的化学结构,有些药物活性成分和/或辅料会被直接接触药品的密封件吸附,造成药品有效成分和/或功能性辅料含量降低,以及理化性质等改变;如无涂层的溴化丁基橡胶塞对丁苯酞注射液中的丁苯酞具有极强的吸附作用,短时间就会造成药品中有效成分大幅度降低。对橡胶密封件用作脂溶性活性成分的包装,要特别关注密封件对药物活性成分的吸附。再有,某些溶液制剂包装密封件,经长期接触后可能会发生溶胀并导致密封件功能改变,从而影响制剂的临床使用;某些特殊配方制剂包装密封件,经长期接触后可能会变脆并导致密封件的密封性变差,从而影响制剂的包装完整性。

2相容性研究的过程
相容性研究的过程主要分为如下6个步骤。
①确认密封件组分的法规适用性以及密封件产品的质量标准适用性,收集进行相容性试验所需要的基本信息。包括与密封件有关的配方信息、加工助剂信息、清洗剂和清洗方式、硅油、涂层材料(如有)、灭菌(如有)等信息;与药品有关的处方组成、关键工艺参数、规格、装量、储存条件、给药途径、给药方式和每日最大临床使用剂量等信息。
②拟定相容性研究的试验方案。根据密封件及药品的特点,确定试验样品的批次及数量;根据包装规格及药品的每日最大临床使用剂量,通过化学计量学计算,制定提取试验样品的制备方法;根据密封件的配方及加工工艺,开发针对相应可提取物的检测方法等。
③对密封件进行提取试验和/或模拟提取试验,对覆膜胶塞和镀膜胶塞可以一起也可以分别进行提取试验;对可提取物的检测方法进行方法学研究;对可提取物进行风险评估并预测可能潜在的浸出物;如果可提取物中出现基因毒性、致癌性物质或其他的毒害物质,需慎重评价其可能的风险,并根据风险程度决定是继续使用或是更换密封件。

④采用使用密封件的拟市售包装的药品进行浸出研究(迁移试验)。对浸出物的检测方法进行充分的方法学研究,确认检测方法能专属、准确、灵敏、稳定地检出待测的浸出物。迁移试验可与药品的加速和/或长期稳定性试验一同设计,检测稳定性试验相应时间点药品中的浸出物,观察浸出物的变化趋势,对试验数据进行必要的统计分析和总结。
⑤进行可提取物和/或浸出物安全性评估,建议采用列表的方式。可提取物包括检测项目(可提取物名称)、提取溶剂及提取条件、分析方法以及可提取物的来源分析;浸出物包括检测项目(浸出物名称)、检测到的最高含量水平、人每日最大摄入量、人每日允许暴露量(permitteddailyexposure,PDE)、安全指数(由浸出物检测最高浓度计算的每日最大摄入量与PDE的比值)等。
⑥对药品与包装所用密封件的相容性进行评估。结合其他如保护性、功能性等适用性要求得出密封件是否适用于药品包装的结论。

相容性研究的主要内容与试验方法
1密封件配方信息的确认
应视情况对密封件的配方信息进行确认;可采用物理的和/或化学的方法。
2药品与密封件相关信息的收集
在设计相容性研究试验方案之前,必须要了解密封件与药品的接触方式及接触
条件,以及密封件的配方、生产工艺、清洗方式和清洗剂等。因一些在工艺过程中用到或接触的物质可能会在生产过程中被带入到密封件中。同时,收集药物制剂的处方、工艺、给药途径、给药频率、给药剂量以及疗程等信息。

3可提取物研究
可提取物研究包括密封件的提取试验和/或包装容器系统的模拟提取试验。密封件提取试验的关注点是材料本身含有的无机或有机可提取物,包括密封件基体材料成分及加工工艺过程中添加的物质(基体组成和加工助剂等)、配方添加物质的降解物,以及其之间的反应产物等。包装容器系统模拟提取试验的关注点则是在药品或模拟药品(当药品成分复杂,对可提取物的检测有干扰时采用模拟药品)与密封件实际接触的情况下,采用超出正常生产、贮藏条件提取得到的无机或有机可提取物。例如,对最终灭菌工艺的注射剂,采用适当提高灭菌温度、延长灭菌时间模拟提取;对吸入制剂,采用高于加速试验条件放置一段时间模拟提取等。
可提取物研究是指采用适宜的溶剂、药品或模拟药品,选用一定的提取方式和提取条件,在较严苛的条件下,对密封件材料或包装容器系统进行的提取试验/模拟提取试验研究。目的是通过良好设计的提取试验/模拟提取试验,对密封件组分中可提取的无机物和有机物进行可能的定性定量研究,用化学分析的方式,同时借助相关文献对可提取物(密封件中溶出的添加剂、覆膜或镀膜材料中添加剂、加工助剂、聚合单体及其降解物等)进行初步的风险评估,提示预测可能潜在的目标浸出物,并依据提取试验/模拟提取试验研究中获得的已知可提取物的种类和水平信息,建立灵敏的、专属的分析方法,以指导后续的浸出物研究。
(1)提取溶剂密封件材料提取试验提取溶剂的选择要充分考虑密封件配方成分的特性;包装容器系统模拟提取试验提取溶剂的选择要充分考虑药品处方组成成分的特性。提取溶剂首选药品溶液或复溶后的药品溶液。有些药品的处方成分比较复杂(如脂肪乳等),或在相对剧烈的提取条件下药品及辅料可能会降解或发生缩合;当以药品溶液或复溶后的药品溶液为提取溶剂存在明显的测定干扰时,可优先选择不含活性成分的空白制剂溶液或接近药品溶液性质的替代溶液(模拟药品)。提取溶剂的选择应兼顾药物制剂处方中辅料的结构或极性的相似性,对于酸性和碱性药物,还应特别考虑提取溶剂的酸碱性与之相似。选择提取溶剂的关键因素包括:溶剂的极性、pH值、离子强度等。研究者应根据药品的理化特性选择提取溶剂或者是在药品溶液的基础上做适当的调整,以下几种提取溶剂仅作为选择的参考(不代表该溶剂适合特定的药品)。

①不含活性成分的空白制剂溶液。
②纯化水。
③酸性缓冲溶液(pH=2.5,pH值应不高于药品实际处方)。
④碱性缓冲溶液(pH值应不低于药品实际处方)。
⑤不同浓度的醇溶液(醇浓度应不低于药品实际处方)。
⑥正己烷或二氯甲烷(适用于气雾剂或特定用途)。
(2)提取方式选择提取方式应重点考虑药品的制备工艺条件及与密封件接触的实际情况,如可以将密封件按照一定的比例浸泡于提取溶剂中。为减小样品的尺寸,或得到更多的可提取物信息,可将密封件切割成小条或块,但应避免如碾磨等剧烈手段;也可以将提取溶剂加入与密封件配套的包装容器(如西林瓶、铝罐等)中,并用密封件密封后进行提取。
常用的提取方式包括在提高温度条件下的加速提取、超声提取、索氏提取、回流提取和强化的灭菌工艺循环提取等。各种提取方式都具有各自的优点和局限,如回流提取的效率较高,但提取溶剂为水溶液时,由于水的沸点较高,回流提取则过于苛刻,可能导致某些有机可提取物发生进一步的降解。在密封容器中采用超出加速试验条件的方式提取可能更接近实际的迁移效果。研究者可根据药品及密封件的特性综合考虑选择适合的提取方式。
(3)检测方法及方法学验证根据密封件的配方和加工工艺,初步确定其可提取物的种类及性质;再根据待测物的性质和测试目的选择适宜的分析方法。
密封件可提取物及分析方法,包括(但不限于):硬脂酸和软脂酸(GC-MS)、正己烷(GC、HPLC)、酚类抗氧化剂(BHT,Irganox1010,Irganox1076) (HPLC)、卤代低聚物(GC)、元素离子(Mg,Ca,Zn,Si,Ti,Al) (ICP-OES)、硫、氯化物和溴化物(IC)、亚硝胺及亚硝胺类化合物(GC-NPD、GC-MS、GC-TEA)、2-巯基苯并噻唑(GC-FPD)、多环芳烃(GC-MS)等。
①检测样本的制备。应根据待测物的性质及检测方法的灵敏度,制备检测样本。因提取液或模拟提取液中可提取物的浓度通常较低,需经过适当的前处理过程制备可提取物检测样本。如分析方法足够灵敏,可采用提取液或模拟提取液直接进行分析测定,无需富集处理。如直接测定提取液或模拟提取液,分析方法的灵敏度达不到检测要求时,常用的检测样本制备方法有:a.减压浓缩富集,采用减压旋转蒸发浓缩的方法制备检测样本,但需注意防止温度过高影响样本中待测物的稳定性,避免样本在富集处理过程中待测物进一步降解的情况发生。b.液相/固相萃取,可提取液或模拟提
取液进行液相/固相萃取;但需注意液相萃取溶剂和固相填料及洗脱溶剂的选择,建议采用加内标的方法,确保待测物的有效富集。c.衍生化,为提高待测物的挥发性或紫外吸收强度,可选择适宜的衍生化试剂对待测物进行衍生化处理。
②检测方法。
a.无机物(元素)。主要为水性溶剂样品,检测方法有:电感耦合等离子体原子发射光谱法(ICP-OES),电感耦合等离子体-质谱法(ICP-MS),原子吸收分光光度法(AAS)等。
b.有机物。有机介质样品或水性溶剂样品,主要检测方法有:高效液相色谱-二极管阵列检测法(HPLC-DAD)、高效液相色谱-质谱法(HPLC-MS)、离子色谱法(IC)、气相色谱-氢火焰离子化检测法(GC-FID)、气相色谱-火焰光度检测法(GC-FPD)、气相色谱-氮磷检测法(GC-NPD)、气相色谱-热能检测法(GC-TEA)、气相色谱-质谱法(GC-MS)和傅立叶变换红外光谱法(FTIR-ART)等。对于需要特别加以关注的物质,如多环芳烃类(PAH或PNA)、N-亚硝胺类、邻苯二甲酸酯类和巯基苯并噻唑(MBT)等,应开发高灵敏度的检测方法对密封件中的可能残留进行检测。
③方法学。首先采用半定量的方法对全部可提取物进行测定,建立方法的AET,然后对超过AET的可提取物进行鉴定,对经鉴定确认结构的可提取物采用对照品/内标法进行定量/半定量测定。

a.半定量方法的方法学确认。半定量方法的确认重点考察方法的系统适用性和灵敏度;例如GC-MS法,选择合适的标准品来评价仪器的系统适用性和灵敏度(检出限),选择合适的内标(可提取物对照品不能获得或其结构尚不能完全确认)建立半定量的分析方法。
b.定量方法的方法学验证。对确定结构的可提取物,采用对照品,进行全面的方法学验证,包括准确度或回收率、精密度(重复性、中间精密度)、专属性、检测限、定量限、线性和范围等。
(4)可提取物结果分析由于初始可提取物的筛选检测常为半定量的方法,且考虑可提取物结构差异响应因子的不同,因此在应用分析评价阈值(analytical evaluationthreshold,AET)的时候,应设立适当的不确定度。对于GC-MS来说常用的不确定度为50%,即将50% AET作为最终的AET。对于检出的超过AET的可提取物应进行鉴定,鉴定方法可以用质谱图的特征离子峰等,被鉴定的可提取物可分为4类。
①确定的。可用现有数据推断化合物的身份或为其身份鉴别提供有力的证据,并有权威标准作为其二维证据。通过相关的研究信息推断待测物的结构,并与标准物质进行比对最终确认。如通过质谱的分子离子峰推断化合物的分子量(或元素组成)、碎片峰分析推断其化学结构,并与标准品具有相同的波谱特征和保留时间。②可能的。可以从现有数据推断化合物的身份或对其身份鉴别提供有力的证据,但缺乏权威标准作为其二维证明。如通过质谱的分子离子峰推断化合物的分子量(或元素组成)、碎片峰分析推断其化学结构。③不确定的。可以用现有数据进行鉴定;但数据不够明确或者不够有力。如只能获得一部分信息,碎片离子,部分基团。④未知的。现有数据无法对化合物进行定性,如没有或信息不足。
(5)密封件材料可能需要重点关注的可提取物(但不限于) 见表3




浸出物研究
潜在的浸出物研究应在药品研发阶段的早期进行,是通过对弹性体材料的模拟提取试验获得的可提取物信息预测潜在的浸出物,为材料的筛选提供支持。正式的浸出物研究则应采用最终包装的药品进行,证明所用包装系统的密封件在拟定的接触方式及接触条件下,浸出物(包括种类和含量)不会改变药物的有效性和稳定性,且不会产生安全性方面的风险。
应至少采用3批药品进行浸出物研究。
(1)试验条件确定浸出物研究试验条件时,应充分考虑药品在生产、贮存、运输及使用过程中可能面临的最极端条件。如果药品存在多种包装规格,一般建议选择该药品上市包装中比表面积最大的密封件。在药品的加速和/或长期稳定性试验的条件下进行浸出物研究。在对不同浓度的产品进行研究时,可采用矩阵法设计进行试验。进行迁移试验时应注意样品的放置方式,应使密封件尽可能与药品充分接触。
(2)试验时间可参考加速及长期稳定性试验的考察时间点设置。加速试验至少应包括0、3个月和6个月的时间点;长期试验应按照稳定性试验的时间点要求,在6个月以后继续累积数据直至货架期,以观察浸出物的变化趋势。

(3)考察项目首先应考虑由提取试验中获得的可提取物信息分析预测的可能潜在浸出物。由于提取试验中的提取溶剂和模拟药品与实际药品的性质仍存在一定的差异,因此在药品放置过程中,密封件中的成分可能会有进一步的降解或者与药品处方中的成分发生反应生成新的物质等,因此在浸出物研究中应增加对这些降解产物和新生成的物质进行考察。
(4)检测方法及方法学验证浸出物检测样本的制备以及检测方法的选择和使用,与可提取物检测基本一致。通常可以先考虑采用可提取物的测定方法进行浸出物研究,如果浸出物与可提取物的种类不一致,即浸出物超出了可提取物的范畴(首先使用全谱扫描方法进行初步筛选,确定是否有进一步降解物和新的物质产生),且可提取物的检测方法不能适用时,则应针对浸出物的实际情况,在可提取物测定方法的基础上进行优化,并对优化后确定的方法进行全面的方法学验证,包括准确度(回收率)、精密度(重复性、中间精密度)、专属性、检测限、定量限、线性和范围等;以确保所建方法可灵敏、准确、稳定地检出药品中的浸出物。
(5)浸出物结果分析对于检出的超过AET的浸出物应进行鉴定并评估其毒性。对单独某种浸出物采用每日摄入量1.5μg/d的SCT计算AET估值。AET估值和终值的转换应考虑所用的分析技术及浸出物的响应因子。在浸出物结构完全未知的情况下,建议不确定度采用50%;如果浸出物的结构类型已知,但结构尚不能完全表征时,可用类似结构的已知化合物的响应因子,计算AET终值。结合药品的临床每日最大使用剂量进行毒理学评估,以确定浸出物水平是否超出人体每日允许暴露量(PDE)。

吸附研究
吸附研究是对药物活性成分或功能性辅料是否会被吸附或迁移至密封件中,进而导致的药品质量和疗效改变所进行的研究。吸附研究通常也是与药物稳定性试验同时进行;样品的放置要求与迁移试验相同。通常可选择加速及长期稳定性试验的考察时间点,主要对药品活性成分的含量以及功能性辅料的含量进行检测,考察含量的变化趋势。必要时应进行平行对照,以扣除药品本身降解的影响。

试验结果分析与安全性评估
1密封件的安全性评估
①密封件加工所用的基体材料及加工助剂应符合相关法规要求。
②密封件中应关注亚硝胺及类似结构化合物的检出。亚硝胺、亚硝基类物质在现有分析技术条件下应不得检出(欧盟指令-93/11/EEC为亚硝胺浸出不得过0.01mg/kg弹性体,亚硝基类物质浸出不得过0.1mg/kg弹性体)。
③密封件中应关注多环芳烃类(PAH或PNA)物质的检出。
④密封件中应关注邻苯二甲酸酯类物质的检出。
⑤密封件中应关注毒性较大的元素或离子的检出。
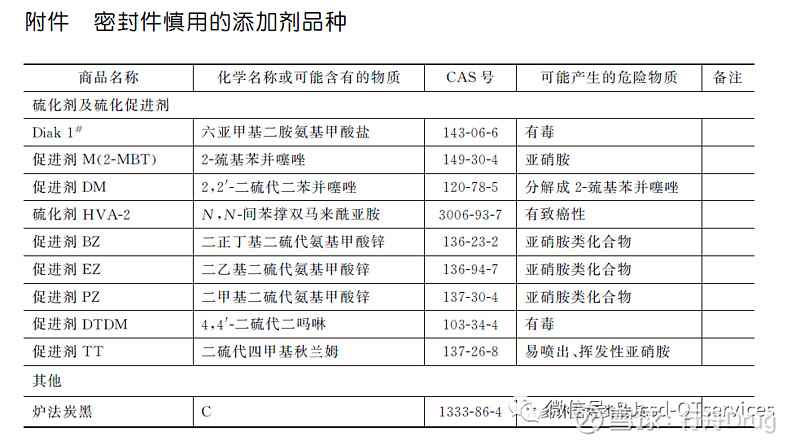
⑥密封件配方中慎用附件中的化学物质,如巯基苯并噻唑类物质等。
⑦必要时密封件可参照USP通则〈87〉、 〈88〉,或参考ISO10993进行体内外生物反应性测试。

2试验结果的评价
(1)PDE法根据制剂的临床使用情况(每日最大使用剂量),由浸出物浓度计算出人每日最大摄入的浸出物量,并与该浸出物人每日允许暴露量(PDE)进行比较,得出该浸出物水平是否符合安全性要求、该密封件是否与药品具有相容性的结论。每日允许暴露量(PDE):①由文献、毒性数据库获得浸出物的PDE;②通过进行相应的安全性试验获得浸出物的PDE (具体的计算方法可参考ICH Q3C、Q3D,并与毒理学专家共同商定)。毒性数据可从结构活性数据库,如DEREK,ToxTree,Leadscope,CCRIS,HSDB,TOXNET,RTECS,TOXLINE CORE,TOXLINE SPECIAL,TOXBIO和TOXCAS,以及互联网等毒理学参考文献中获得。
(2)SCT或QT法由文献、毒性数据库无法获得浸出物的PDE,且又未进行相关的毒性试验时,可采用安全性关注阈值(safetyconcernthreshold,SCT)进行评估(不同给药途径的SCT不同)。对于无文献或无安全性数据的浸出物,当每日摄入量小于SCT时,即使该浸出物具有致癌性,其对安全性的影响也可以忽略不计。无需鉴定SCT以下的浸出物及进行其他研究。对大于SCT的浸出物需进行鉴定。对不含警示结构的非致癌毒性的浸出物,如每日最大摄入量小于界定阈值(qualificationthreshold,QT)时,也无需进行安全性评估。美国产品质量研究学会(ProductQualityResearchInstitute,PQRI)推荐吸入制剂的SCT为0.15μg/d,QT值为5μg/d。对注射剂和眼用制剂,建议的SCT为1.5μg/d,刺激性/致敏性阈值为5μg/d;如浸出物被确认为非致癌性、非刺激性/非致敏性物质,一般毒性阈值为50μg/d。ICH M7 AssessmentandControlof DNA Reactive(Mutagenic)ImpuritiesinPharmaceuticalstoLimitPotentialCarci-nogenicRisk》,DNA诱变杂质的TTC为1.5μg/d;与PQRI推荐的注射剂和眼用制剂的SCT相同。对于毒性特别强的物质,如N-亚硝胺类(N-nitrosamine)、多环芳烃(PAH或PNA)或2-巯基苯并噻唑(2-mercaptobenzothiozole)等,不可采用以上两种评估方法,需根据具体情况制定更低的可接受限度。

3分析评价阈值
基于安全性关注阈值(SCT)以及药物制剂的规格、每日最大临床使用剂量等因素,将SCT转化为分析评价阈值(analyticalevaluationthreshold,AET);然后结合提取试验中与提取溶剂直接接触的密封件表面积/质量以及提取溶剂的用量,计算提取试验的AET估值;或者结合制剂生产、运输、贮藏和使用过程中与药物溶液直接接触部分的密封件表面积/质量以及药液体积,计算浸出物研究的AET估值;最后,根据分析方法的不确定度等,计算AET终值。不确定度通常取50% AET估值或者与标准品比较的响应因子法,二者取较大值。对于GC-MS法,一般可采用AET估值的1/2作为AET终值。可提取物和浸出物在测试样本中多为痕量水平,分析方法的灵敏度必须满足AET终值浓度水平的测定需要。对于浓度水平达到或超过AET值的可提取物和/或浸出物,需要对其进行鉴定及安全性评估。对于吸入制剂,将SCT转换为AET的通用公式如下:




4可提取物研究结果评价
①对于不超过AET的可提取物,可认为该可提取物导致的安全性风险小,在后续的浸出物研究试验中可省略对该可提取物的研究。
②对于高于AET的可提取物,需进行鉴别或结构确认以及半定量分析,进行初步毒理学评估以判断该物质是否对人体有害。若该可提取物对人体无特殊安全性风险或未表现出结构活性关系(SAR)的风险,按每日临床使用最大剂量折算的可提取物量低于QT,则在后续的浸出物研究试验中可省略对该可提取物的研究;若该可提取物对人体有特殊的安全性风险或具有结构活性关系(SAR)的相关风险,则需在后续的迁移试验中进行该可提取物的研究。但是,上述评估应基于良好设计的提取试验获得的可提取物结果,即可提取物能反映浸出物的情况;否则仍应在后续的迁移试验中进行相应可提取物的研究。

5浸出物研究结果评估
如果浸出物含量低于人每日允许暴露量(PDE)或SCT时,可认为浸出物的水平对人体产生的风险是可以接受的。如果浸出物的含量高于PDE,则认为浸出物的水平所产生的风险是不可以接受的。在这种情况下,如确认高于PDE的浸出物源于密封件,则建议更换密封件(相同材质密封件的不同供应商或不同材质的密封件),若无可更换(经研究后已无其他更好的选择)则应进行风险与获益分析权衡利弊,确保风险可控。如果浸出物的含量高于SCT,需对化合物进行鉴定,并明确是否存在警示结构。如存在警示结构,建议进行该浸出物的细菌回复突变(Ames)试验;如其Ames试验结果为阳性,则建议更换密封件;如不存在警示结构,则该浸出物的含量不得超过QT,否则应进行毒理学评估。
6吸附研究结果评估
如果吸附试验结果显示密封件对药品活性成分或功能性辅料存在较强的吸附,并对药品的质量及疗效产生显著影响时,建议采用适宜的方法消除这种影响,例如,更换弹性体品种或采用覆膜胶塞等。


文章信息源于公众号国联药检,登载该文章目的为更广泛的传递行业信息,不代表赞同其观点或对其真实性负责。文章版权归原作者及原出处所有,文章内容仅供参考。本网拥有对此声明的最终解释权,若无意侵犯版权,请联系小编删除。
学如逆水行舟,不进则退;
心似平原走马,易放难收。

行舟Drug
每日更新 欢迎订阅+
医药大数据|行业动态|政策解读