点击上方的 行舟Drug ▲ 添加关注
眼科药物的药动学研究策略

来源

《中国新药杂志》2021 年第30 卷第18 期

作者

宋硕,王若男,钱仪敏,孟永,周璐,李华
中国医药工业研究总院国家上海新药安全评价研究中心
上海益诺思生物技术股份有限公司
益诺思生物技术南通有限公司

摘要

眼药动学是研究药物在眼组织中的吸收、分布、代谢和排泄的过程,并可用数学模型定量描述,相对于整体药动学更精细、复杂。眼药动学研究是眼科药物开发和指导眼科临床合理用药的关键。因此,全面了解眼药动学的研究内容对眼科药物开发人员和使用人员来说都是非常重要的。
本文概述了眼药动学研究中的重点内容,方便相关眼科研究人员对眼科用药的药动学有一个整体的认识,提高眼科用药的安全性和合理性。

关键词

屏障; 给药途径; 眼药动学
_
正文
_
药动学( Pharmacokinetics,PK) 是研究药物的体内过程( 吸收、分布、代谢和排泄) ,并运用数学原理和方法阐明药物在体内的动态规律的学科。
眼科药动学是药动学的一个分支,系研究眼球各组织对药物吸收、分布、代谢和排泄的时间过程,并可用数学模型表示。药物的吸收、分布、代谢和排泄的动力学过程决定了药物在眼组织中的时间进程和到达作用部位的量,了解这些相互关联的过程对决定药物的剂量和给药频率至关重要,从而影响其疗效和安全性。
1
眼部给药屏障
眼部给药屏障分为生理屏障和解剖学屏障。生理屏障包括泪液周转、鼻泪管引流和眨眼,可防止病原体入侵,但也会阻碍药物在眼部的递送[1]。眼球的具体解剖结构见图1,其解剖学屏障分为静态屏障和动态屏障。
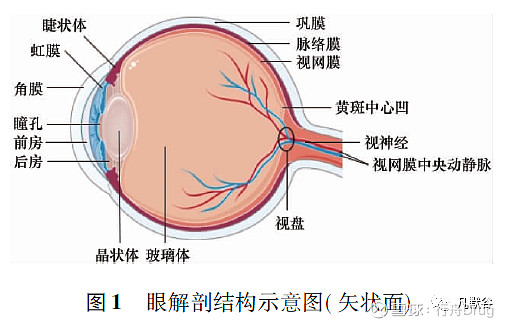
眼前节静态屏障包括角膜上皮、基质和血房水屏障( blood-aqueous barrier,BAB) ,动态屏障包括结膜血、淋巴流动和泪液引流。在眼后节,静态屏障包括巩膜、Bruch's 膜-脉络膜( Bruch's membrane-choroid,BC) 、视网膜色素上皮( retinal pigment epithelium,RPE) 等,动态屏障涉及通过血、淋巴参与的药物清除[2]。黏蛋白也是眼部给药的一个障碍,呈凝胶状,在角膜和结膜表面形成屏障层,起到保护作用,通常也被认为是一种渗透屏障,限制眼部药物的吸收[2]。眼部给药屏障之间的关系图见图2。
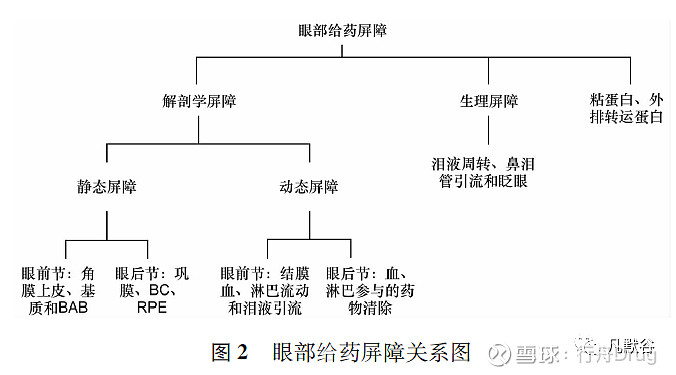
传统的眼部给药屏障主要指血眼屏障( blood ocular barrier,BOB) ,BOB 由BAB 和血视网膜屏障( blood-retinal barrier,BRB) 组成。BAB 通过虹膜毛状毛细血管限制药物从血液到房水的运动[3],药物透过BAB 的通透性由药物分子的渗透压和理化特性决定[4]。BRB 包括由视网膜色素上皮细胞层构成的外部血视网膜屏障( outer blood retinal barrier,oBRB) 和由视网膜毛细血管内皮细胞构成的内部血视网膜屏障( inner blood retinal barrier,iBRB ) 。oBRB 和iBRB 都是血液和视网膜之间的渗透性屏障,细胞之间存在致密的连接蛋白[5]。
眼部给药屏障的存在直接或间接导致了药物在眼部的生物利用度较低。同时其他因素也会影响眼部给药的生物利用度,主要有药物与眼组织中的黑色素或蛋白结合、全身性药物吸收、药物代谢酶的影响等。例如分子量较小的亲脂性或阳离子性药物可以与虹膜或睫状体等眼组织中的黑色素结合,从而减少在其他组织中的分布。黑色素结合可能导致药物释放缓慢或蓄积,导致潜在毒性。因此,描述药物在眼组织中的药动学过程和在眼组织的体外代谢时,必须考虑与黑色素的结合[6]。
所有碱性和亲脂性药物都可能与黑色素结合,如吩噻嗪类抗精神病药( 氯丙嗪) 、喹诺酮类抗生素( 环丙沙星、氧氟沙星) 和喹啉类抗疟药( 氯喹、羟基氯喹) 等已被证明能和眼组织的黑色素结合[7]。在药物递送领域可以利用药物与黑色素的亲和性,增加眼底疾病治疗药物的靶向性。
内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。
2
眼部给药途径
眼部给药途径较多,包括局部( 结膜囊内滴眼) 给药、全身给药、结膜下注射、前房注射和玻璃体注射等。不同眼部给药途径的优缺点比较见表1。

局部给药是最适合眼科患者的给药途径,因为眼表是眼部给药最容易到达的部位,作用更直接,特别适用于眼前节疾病的治疗[8]。局部给药可以避开肝脏的首过效应,避免口服给药需要的更高的剂量,降低潜在不良反应。然而,角膜、结膜、RPE 和动态屏障等多种眼屏障的存在,使药物损失过多,仍然是局部给药的主要缺点。
眼部注射给药主要包括前房注射、玻璃体腔注射和眼周注射等。前房注射直接将药物注入前房,一般用于白内障手术后预防眼内炎发生,也可用于治疗真菌性、细菌性角膜炎等眼前节病变,但前房注射无法使药物在眼后节达到有效治疗浓度。玻璃体腔注射能使眼后节达到有效药物浓度,但存在高眼部并发症和视网膜损伤的风险。为了延长玻璃体注射药物的持续作用时间,开发了玻璃体注射植入剂。其能延长作用时间,减少给药频率,增强治疗效果。玻璃体植入剂也有了很大发展,从静态到自由浮动植入剂,从非生物降解到可生物降解植入剂[9]。
与玻璃体注射相比,眼周( 如结膜下、球后、球周) 注射的眼部疼痛、感染、眼内炎或出血的风险相对较低,药物作用时间更长,且药物可通过巩膜、脉络膜循环等途径到达眼后节。Sub-Tenon 途径是将药物注射入眼球筋膜鞘( Tenon 囊) 和巩膜间的腔内,并发症较少,比球后和球周注射给药用于眼部麻醉效果更好[10],但仍可导致结膜水肿或结膜下出血。因此,开发安全有效、能够较长时间维持靶部位的治疗药物浓度,而不会造成眼部损害或不适的新型给药系统是非常重要的[11]。
3
眼药动学
3.1 眼药动学模型
3.1.1 房室模型
经典的房室模型将眼近似分为一系列代表眼睛内关键目标组织的房室,在模型中指定的位置和方式给药,通常假设药物在房室之间进行一级动力学过程。在一个房室模型中,用来描述眼系统的房室数量通常是根据经验或实验需要合理推导出来的,可能与实际生物系统的生理学或解剖学无关[12]。目前研究和使用较多的是单室模型和二室模型,更为复杂的多室模型也有一定研究,虽然多室模型能够更好地反映药物在眼组织的药动学情况,但因为建模复杂,数学处理过程相当繁琐,其应用受到了一定限制。
与研究整体药动学房室模型一样,研究眼房室模型时,人为地将眼睛的各个组织结构看作是一个由屏障与其他房室分隔开的独立房室,从而构成不同的房室模型,药物在其中被处置的速率过程也和整体药动学相同,都是在Fick's 定律的基础上推导得到的。例如,将泪液看作一个周转恒定的房室,构成单室模型,泪液的流入是恒定的,给予亲水性药物后,泪液迅速和药物混合,并且在单位时间内通过眨眼和泪液稀释带走一部分药物[13]。
同样地,单独研究药物在角膜、结膜、房水、玻璃体等眼组织中的动力学过程时,这些组织也可以被作为单室模型。兔眼玻璃体中注射阿柏西普1,48 和24 h 后分别在玻璃体、房水和视网膜中检测到阿柏西普的最大浓度,因此选择单室模型作为3 个眼组织的最终模型。在玻璃体、房水和视网膜中,阿柏西普的半衰期分别为94.1,48.0 和58.2 h; 平均滞留时间( mean residence time,MRT) 分别为135.8,69.2 和84.0 h; 血药浓度-时间曲线下面积( AUC0 - t) 分别是135 810.6,13 889.7和2 453.1 h·μg·mL- 1[14]。
当研究药物在眼组织的多个不同房室间的动力学特征时,可以将不同的眼隔室作为整体来研究,从而构成二室模型、三室模型、四室模型以及更加复杂的多室模型。如结膜囊内滴眼给药时,1%的药物穿透角膜上皮屏障进入角膜基质,将角膜作为第二个腔室,与泪液构成二室模型。Hutton-Smith 等[15]利用家兔药动学数据得出视网膜渗透系数和流体动力学之间的关系,描述了一个由视网膜、玻璃体和房水组成的三室模型,并估算了视网膜与玻璃体和视网膜与脉络膜之间的大分子渗透系数的参考值。根据这些数值,使用该三室模型来分析使用雷珠单抗治疗的湿性年龄相关性黄斑变性患者房水中游离( VEGF) 的水平,并将其与模拟视网膜中游离VEGF 的水平进行了比较。Djebli等[16]采用自上而下的群体方法,通过测定兔眼前节新型酪氨酸激酶( Src) 抑制剂FV-60165 的浓度,建立并验证了群体药动学模型( population pharmacokinetic model,PopPK) ,评估个体间的变异能力,并评估处方( 溶液和纳米悬浮液) 的影响。结果由泪液、鼻泪管、角膜和房水组成的该四室模型,显示了良好的预测性,可评估每只动物在单次或多次给药后各眼组织的药物浓度-时间曲线。
基于生理学的药动学( physiologically based pharmacokinetic model,PBPK) 模型通过将房室与特定组织联系起来,并将生理、生化和解剖学的各个方面纳入房室模型的相互联系中,从而改进经典房室模型[17]。此外,PBPK 模型使用观察到的生理过程,如流体流速,作为量化房室间交换的基础。使用隔室的方法,将信息录入软件系统中,来表示各种药物在眼部的药动学特征。PBPK 模型更加接近机体环境,但是建立模型比较复杂,需要更多的信息参数和对复杂数学的解析能力,而且一些生理、生化参数也不易获得。尽管PBPK 模型还需要进一步开发,但它代表了一种未来仅在体外对局部眼科产品进行生物等效性评价的方法。该模型的建立不仅将减少产品开发所需的动物数量,而且还将作为开发临床眼部PBPK 模型的经验平台,为新产品的开发提供信息[18]。
3.1.2 动物模型
由于需要进行侵入性取样使得人眼药动学研究受到伦理限制,因此对人眼的药动学研究较少。眼药动学研究主要依赖于动物模型,啮齿类动物、家兔、犬和非人灵长类是临床前眼药动学研究常用的动物模型,其中家兔是使用最多的动物之一,其眼解剖结构与人眼相似,便于实验操作和观察,与其他大型种属如犬或非人灵长类动物相比,具有广泛的可用性和经济性[19]。
Ozcimen 等[20]使用兔葡萄膜炎模型,研究静脉给予替加环素的眼药动学,结果玻璃体和房水的药物浓度明显较低,而血浆的药物浓度较高,说明静脉给予替加环素不是治疗细菌性眼内炎的合适途径,应考虑改变给药途径或更换药物。
但是动物模型的局限性也是多方面的,不能将动物模型的眼药动学数据直接外推到人眼。比如人与动物玻璃体体积存在显著差异,人玻璃体体积为4 mL,而猴、家兔、大鼠的玻璃体体积分别为1. 9,1. 5 mL 和50 ~ 55 μL。玻璃体中扩散路径长度的差异( 家兔为9 mm,而人类为22 mm) 会影响药物的分布,且与人眼相比,兔眼后节药物清除半衰期缩短了1. 7 倍,眼前节药物清除半衰期缩短了2 倍。此外,PK 研究通常在年轻动物身上进行,没有潜在的病理过程,它们的玻璃体特性可能无法与同时存在视网膜或脉络膜病变的老年人的眼睛相比较。因此,适当的实验设计和模型动物对眼药动学研究至关重要,此外,选择合适的剂型来克服这些障碍也是眼部给药的关键[19]。
利用动物模型进行眼PK 研究时,传统的取样( 房水、玻璃体、视网膜等) 方式、检测方法和测量技术各不相同,但都难以获得关于局部/眼内分布和清除的信息。临床前眼药动学研究通常在给药后的不同时间点处死动物、取样和检测不同眼组织浓度,每次研究需要大量动物,非常麻烦且价格昂贵,以及存在解剖方法不当而导致化合物重新分布的风险。
复杂而独特的眼解剖结构以及侵入性的取样方式,导致对眼部药物的动力学过程缺乏完整的认识。因此,非侵入性、实时可视化、定位、表征和量化的分子成像技术在眼科的应用,成为眼科新药和剂型开发的转折点,更加符合动物研究的3Rs 原则,提供了更好的动物福利。
目前应用较多的分子成像技术主要是光学成像技术( 例如光学相干断层扫描、荧光光度法) 、正电子发射断层扫描( PET) 、单光子发射计算机断层扫描( SPECT) 、超声波检查和磁共振成像( MRI) 。在这些成像技术中,虽然没有一种成像技术同时具备高灵敏度、高特异性、高时间和空间分辨率的特性,但可通过结合不同成像技术提供的信息来研究药物的眼药动学过程。通常使用的组合是PET 和SPECT,具有高灵敏度,以及像计算机断层扫描( CT) 和MRI 等形态学技术的组合应用较多[21]。
3.1.3 模拟模型
药动学模拟模型( simulation model)可分为描述性模型、解释性模型和预测性模型,能够以简单的如数学方程的方式来描述实验数据、解释复杂机制,或预测模型参数的变化对系统结果的影响。利用模拟模型评价药物以支持药物开发,已经获得了越来越多的行业和监管机构的认可,目前主要应用于口服药物递送[22]。
该方法在定量结构活性和性质关系( QSAR/QSPR) 的基础上,极大地促进药物分子的合理设计,指导药物产品开发,提高药物的体内性能,也可实现将体外和体内动物药动学数据外推到人,支持剂量选择和临床试验方案设计,以及对生物制剂进行生物等效性( bioequivalence,BE)评估[23]。
近年来,模拟模型在眼科药物研发中的应用取得了长足进展,已开发的一些软件程序在眼科药物开发和评价方面取得了良好的应用效果,利用数学原理,使用计算机模型来模拟疾病模型也有一定的研究进展。
计算机辅助设计( computer aided design,CAD)软件已用于构建人、猴和家兔眼解剖学的精确模拟模型。Deng 等[24]使用Stella 10.0.3 软件构建模拟系统,预测了匹罗卡品和氟乙基酮在角膜上皮和体液中的浓度,该模型不仅对多种处方具有很高的准确性,还包括了图形和用户界面,方便用户修改参数,从而模拟各种公式。
MATLAB平台被用于模拟局部滴眼和眼内注射几种化合物和曲安奈德后的药动学参数,分别在家兔和患者中进行局部给药后,成功预测了眼组织和全身的药动学数据,包括房水、玻璃体、虹膜睫状体和血清中几种化合物和曲安奈德的浓度随时间变化的关系[25]。
GastroPlusTM眼吸收和运输( OCATTM) 软件模块是目前最先进的模拟模型程序,OCATTM不仅为人类、家兔和非人灵长类提供默认的眼生理学,而且还有用户自定义的眼生理学选项。OCATTM几乎涉及全部眼组织,还包括鼻泪管引流以及经结膜、脉络膜和视网膜到体循环的药物吸收,采用PBPK 模型计算到达体循环的药物分布。药物在不同眼组织间的分布和转运通过被动扩散、载体介导过程和对流流动来描述。药物代谢和药物与黑色素结合可以用线性或饱和过程来建模,并且药物代谢和药物与黑色素结合程度可分别用总酶表达量和相关眼组织黑色素含量来测定[26]。
利用数学原理进行模拟模型建模,主要使用有限元或有限体积的方法,从而准确地代表眼解剖学和生理学。Aukje 等[27]通过使用离散数据模拟( discrete event simulation,DES) 构建青光眼模拟模型,将目前关于高眼压和青光眼预后因素和疾病进展之间的关系转化为DES 模型元素,该模型可用于模拟处理有限元素和结果之间的关系,在多个层次上进行了验证并定义了临床和健康结果。
3.2 药物在眼组织的吸收和分布
眼组织的解剖结构和生理特点以及药物自身的理化性质都会影响药物在眼组织的吸收和分布。例如,局部给药时,药物在眼组织中的吸收主要有2 个途径: 角膜途径,经角膜吸收入眼; 非角膜途径,经结膜、巩膜等吸收入眼。其中经角膜途径是由泪液进入前房,是局部给药时药物吸收的主要途径[28]。
药物的理化性质决定了其角膜通透性的大小,角膜上皮细胞层和内皮细胞层阻止亲水性药物分子进入房水,允许亲脂小分子通过。而角膜基质层阻止亲脂性药物分子的通过,允许亲水性药物分子透过。这种“三明治样”的结构使角膜成为大多数亲脂和亲水药物的独特屏障,因此,只有具有合适脂水分配系数( log D 值在2 ~ 3 之间) 的药物分子才能顺利透过角膜被吸收。此外,角膜表面一般带有负电荷,表面带正电的药物分子比带负电的药物分子更容易与角膜结合并透过[29]。药物理化性质对各眼组织药物吸收的影响见表2。
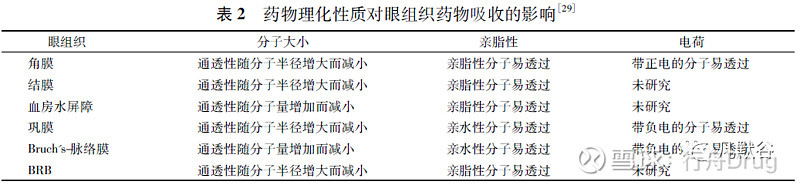
除了角膜屏障,BAB 以及眨眼、结膜血、淋巴流动和泪液引流等都会大大减少局部给药时药物在眼表的滞留时间,从而使眼组织对药物的吸收减少。因此,可以通过改变剂型增加药物在眼表的滞留时间来增加局部给药时药物的吸收量,或者采用玻璃体注射等注射途径绕过药物的吸收过程,使药物直接分布到靶组织。
药物在眼前节分布的速度和程度取决于许多因素,包括渗透性、在房水中的扩散速度、与蛋白质和周围眼组织成分的结合能力,这些因素大多受药物的理化性质的影响,包括亲脂性、溶解度和分子量等[30]。由于药物剂型和理化性质的不同,药物在局部给药后可到达眼睛的不同部位,经局部扩散及房水循环进入眼内各组织,但主要分布于结膜、角膜、房水、虹膜、睫状体等眼前节组织。
Wang 等[31]采用LC-MS 法测定新西兰白兔单眼给予0.05 mL 1%阿托品滴眼液后,在5,24,72 h 各眼组织中阿托品的浓度; 采用基质辅助激光解吸电离-成像质谱联用技术( MALDI-IMS) 以成像方式研究C57BL /6J 小鼠给予1%阿托品滴眼液后5 h 阿托品在眼组织的分布。结果发现: 5 h 后,阿托品在新西兰白兔结膜的平均浓度最高为( 19. 05 ± 5. 57) ng·mg- 1,且在给药后5 h 内阿托品转移到未给药的对侧眼。通过MALD-IMS可以清楚地看到阿托品在C57BL /6J 小鼠眼组织中的空间分布情况。
3.3 消除速率过程
药物在眼组织中的消除过程包括代谢和排泄过程,受药物溶解度、分子大小、浓度以及眼解剖结构和生理状况等多种因素影响。局部给药时大部分药物通过鼻泪管流失,然后被全身吸收,这部分药物通过全身系统途径代谢和消除。剩余的药物经角膜吸收,分布到眼前节各眼组织,然后小分子药物通过房水循环及虹膜、睫状体的血流被消除,清除率为5 ~35 μL·min- 1。大分子药物仅通过房水循环消除,清除率为2.4 ~ 5.2 μL·min- 1。兔眼房水的周转率为每分钟前房容积的1.5%,房水约46 min 更新一遍,由于房水周转率快,药物随房水的消除也较其他眼前节组织快[30]。
Schopf 等[32]研究了新西兰白兔局部滴眼给予依碳酸氯替泼诺,其在角膜、结膜和房水中的消除半衰期分别为3.75,4.26 和2.31 h。Wen等[33]局部给予新西兰白兔磷酸舒林酸( OXT-328)的纳米粒制剂后研究其药动学过程。在体循环中未检测到磷酸舒林酸及其代谢产物。在眼组织中检测到磷酸舒林酸的一系列已知代谢物舒林酸、舒林酸硫化物和舒林酸砜,尤其是角膜和结膜中代谢物浓度最高,是磷酸舒林酸在眼干燥症中最重要的治疗靶点。
玻璃体中药物的消除主要有2 种途径: 在眼前节,玻璃体中的药物扩散进入后房,随后通过房水循环和葡萄膜血流进行消除; 在眼后节,药物穿过视网膜,最终被脉络膜血流消除。由于相对较大的表面积、组织分配和主动转运机制的参与,被眼后节脉络膜血流消除的分子在玻璃体中的半衰期通常很短[34]。因此,药物分子的理化性质决定药物从玻璃体消除的主要途径。
亲脂性和小分子药物在BRB中具有高通透性,大多在眼后节被消除,而大分子和亲水性药物由于难以透过BRB 仅在眼前节被消除。例如,Ramsay 等[35]通过LC-MS /MS 定量测定环丙沙星等8 种小分子药物和贝伐单抗在离体牛眼RPE-脉络膜的双向通透性,即药物从玻璃体到体循环的清除和药物从体循环到眼组织的分布,来研究RPE 的清除率( CLRPE) ,作为药物消除的一部分。其中6 种小分子药物的外向CLRPE值与玻璃体内清除率( CLIVT) 值相当,而贝伐单抗的CLRPE仅占CLIVT的3.5%,证明贝伐单抗玻璃体注射后的主要消除途径不是通过透过RPE 后的脉络膜血流来消除,而是通过眼前节途径被消除。
4
结论
由于眼部屏障的独特性、眼前节和眼后节药物作用部位不同以及给药途径的多样性等,使得眼药动学比全身药动学更加复杂,因此,全面认识眼组织结构和特性、综合考虑各方面因素对眼科药物开发和应用的影响是理解眼组织与药物相互作用、指导眼科合理用药的关键。本文介绍了眼部屏障、常见的眼部给药方式、房室模型、模拟模型、动物模型以及药物在眼组织的动力学过程,是眼药动学研究中的重点,方便眼科研究人员和药物开发人员对眼部给药的眼药动学有一个整体的认识。
当前眼药动学的相关研究还相对较少,一些替代模型仍处于早期研究阶段。而系统了解眼药动学和替代模型的建立有助于将药物药理学特性、给药系统相关因素、眼球解剖学和生理学以及物种间因素整合在一起,从而促进眼科药物的开发和剂型改进等。同时,眼科药效学研究作为眼科药理学的重要组成部分,是一个重要的挑战,一方面缺乏评价药效的相关动物模型,离体或体外替代模型则更少; 另一方面多数药物在眼组织中的作用靶点和机制尚不明确,需要更加深入的机制研究。在给药系统、给药频率和给药途径设计中,必须充分利用药物信息。大分子生物制剂具有非常广阔的眼科应用前景,也是未来眼科药物开发的重点,很多目前用于眼后节疾病的药物就是生物制剂,比如治疗湿性年龄相关黄斑变性的雷珠单抗、康柏西普等。此外,成像技术等新技术和纳米材料等新材料在眼科领域的应用,也将极大地推进眼药动学研究,进而加速眼科药物开发、指导临床合理用药。

参考文献

详见《中国新药杂志》2021 年第30 卷第18 期
文章信息源于公众号凡默谷,登载该文章目的为更广泛的传递行业信息,不代表赞同其观点或对其真实性负责。文章版权归原作者及原出处所有,文章内容仅供参考。本网拥有对此声明的最终解释权,若无意侵犯版权,请联系小编删除。
学如逆水行舟,不进则退;
心似平原走马,易放难收。

行舟Drug
每日更新 欢迎订阅+
医药大数据|行业动态|政策解读