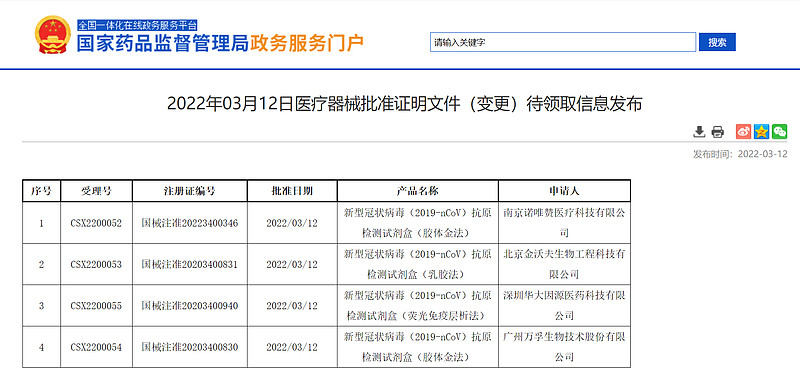
$华大基因(SZ300676)$ $万孚生物(SZ300482)$ 2022.03.11和2022.03.12,连续两日,NMPA批准5款自测版的新型冠状病毒(2019-nCoV)抗原检测试剂盒。即居民可居家检测。

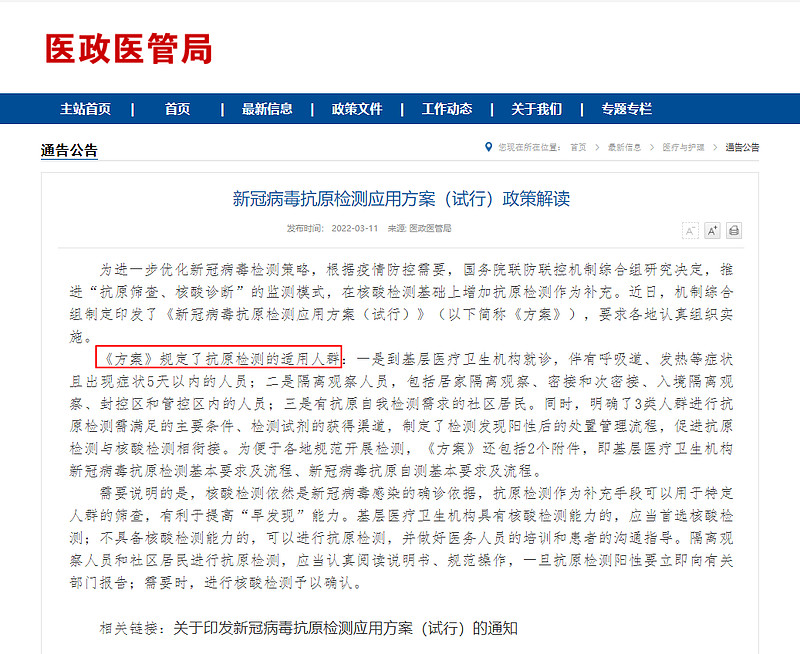
2022.03.11,国家卫健委为进一步优化新冠病毒检测策略,根据防控要求,决定推进“抗原筛查、核酸诊断”的监测模式,在核酸检测基础上增加抗原检测作为补充。同时规定了以下3类人群可以自我开展检测。
国际上
随着奥密克戎在全球感染量上升,新冠自测试剂盒在全球多个国家需求量持续增加,市场规模或可达千亿。
澳大利亚
,单次自测试剂盒的价格在几周内从10 澳元(约44.36元)涨到70 澳元(约310.51元人民币);
美国政府
日前宣布向全美家庭免费提供4次自我检测试剂盒;
去年4月,英国政府宣布向居民提供每周2次免费新冠自测,如阳性再前往医疗机构做核酸检测。
截至3月11日,中国尚未批准任何一款新冠抗原自我检测试剂盒。此次连夜批准五款产品上市也及时补充了这一巨大需求市场空缺。
目前中国防疫需求下,进行更便捷、规模更大的筛查很有必要。
而新冠抗原自检试剂盒无须专业医师指导,可以在居民家庭内部快速完成,15-20分钟即可出结果,能有效降低接触暴露风险,减少对医院、三方实验室的资源占用,通常用于居民大范围的普筛自查。虽然由于方法学的不足,新冠抗原自检的灵敏度、准确性低于核酸检测,且检测结果需要个人上报,这一产品也是对核酸检测的有效补充。