作为医药人,很负责的说恒瑞不是闹出了国际大笑话,而是本身对于连云港身边基地的管理出了问题,质量负责人难辞其咎,质量管理混乱不堪,四年多没有接受审计,自我感觉良好!
以下是:CPHI制药在线 文章
近期,医药界朋友圈和各群聊中广泛传播了一则关于国内某工厂遭受FDA(美国食品药品监督管理局)严重审查并收到警告信的新闻。这份长达8页的FDA 483表中,共详细列出了八项主要观察项,此次事件不仅引起了行业内外的广泛关注。本文旨在FDA483表展开讨论,案例仅供参考,如有解读不当,欢迎留言补充。
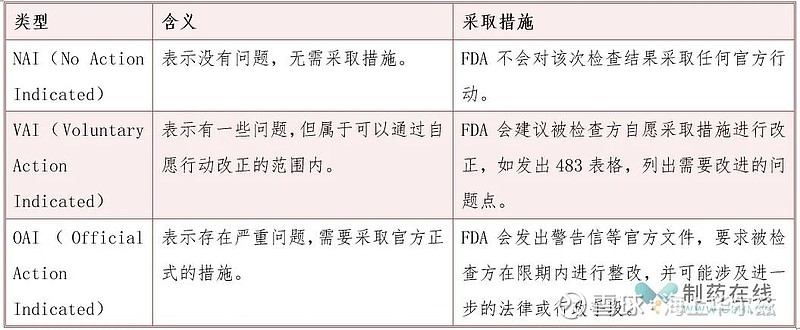
一、FDA审查结论类型
FDA官网公开资料显示,FDA审查结论主要有三种,包括NAI、VAI和OAI,这些结论和措施是基于FDA对被检查方的合规性、生产质量、风险控制等方面的评估而得出的。每种结论都代表着FDA对被检查方当前状态的不同评价,以及对其未来行动的不同期望和要求,各类型含义及采取措施如下表:
二、国内某工厂FDA483表浅析
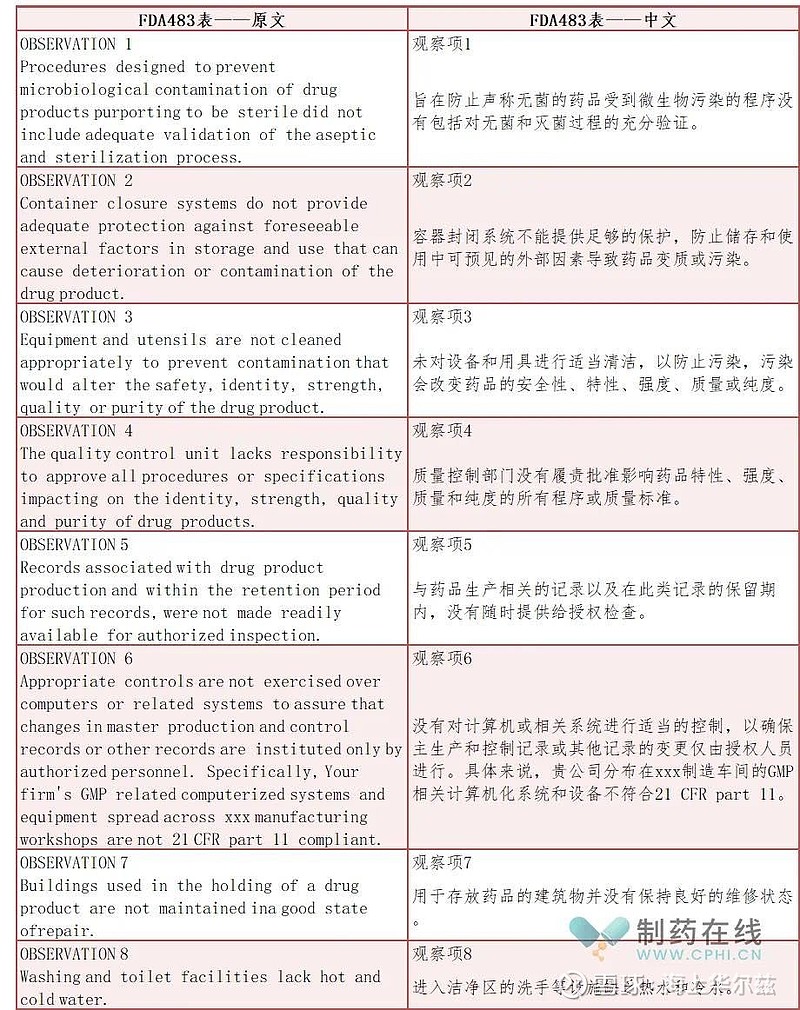
FDA 483表,也称为"inspectional observation",是FDA记录和报告对药品等方面进行的监管检查中发现的不合规性问题时使用的表格。当调查人员观察到违反《食品药品和化妆品法案》及相关法案的任何情况时,在检查结束时都向接受检查的公司管理层发出FDA 483 表格。本次国内某工厂审查遭FDA最严重审查的警告信,483表信息共8页,列举了观察项共8项,笔者梳理了一下FDA483观察项问题。
好好跟华海药业多学习,早日复查风险吧。
国内对应FDA审计的标杆企业看华海就行了。
$华海药业(SH600521)$