近日, $Sutro Biopharma(STRO)$ 宣布FDA已授予其开发的用于治疗先前已接受过1-3线全身性治疗,铂耐药性的上皮性卵巢癌、输卵管癌、原发性腹膜癌的ADC新药STRO-002快速通道认定,目前该药处于临床I期剂量扩展阶段,这意味着Sutro Biopharma可以就STRO-002与 FDA更加频繁地沟通,让FDA更早介入研发过程并给出指导意见,从而加快研发速度。
STRO-002靶向的是叶酸受体α(FRα),由Sutro Biopharma利用其特有的无细胞蛋白质合成平台XpressCF®和基于非天然氨基酸的定点偶联平台XpressCF+™开发而成。针对晚期、进行性上皮性卵巢癌患者的I期剂量递增试验基本情况如下:
患者基线:入组的39名患者中位年龄为61岁(范围48-79岁),先前治疗线数中位数为6,100%接受过至少一种基于铂的治疗方案,46%接受过至少三种基于铂的治疗方案,82%接受过贝伐珠单抗治疗,59%接受过PARP抑制剂治疗,21%接受过免疫检查点抑制剂治疗,36%接受过其他药物治疗。
临床结果:截止2021年1月30日,以临床有效剂量(≥2.9 mg/kg)治疗了34例患者。在31名可评估患者中,10例ORR(32%),1例CR(3%),4例明确PR(cPR)和5例未明确PR(uPR)。对于5名确认应答者(1例 CR和4例cPR),mDOR为5.8个月(95% CI:2.0,不可评估)。中位研究随访时间为8.4个月,mPFS为7.2个月(95% CI:4.5,10.8)。
不良事件:治疗相关86%的AE为1-2级,最常见的3-4级AE是中性粒细胞减少症(64%)、关节痛(13%)、疲劳(10%)、神经病变(8%)、腹痛(8%)。在两名剂量较高的患者中观察到剂量限制性毒性(DLT)— 6.0 mg/kg(2级神经病变/3级关节痛)和6.4 mg/kg(3级骨痛)。
一点结论
FRα受体是ADC开发领域比较冷门的靶点,该靶点最近为人所知是BMS与卫材就MORAb-202达成31亿美元的交易,针对该靶点目前全球仅有3款处于临床开发阶段的ADC。
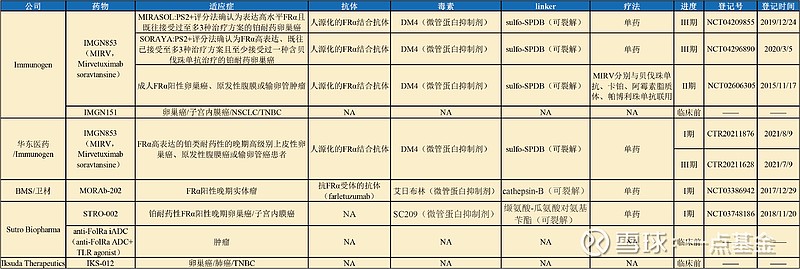
图1 FRα ADC药物竞争格局(公开资料,一点基金整理)
工业界对该靶点热情不高的原因在于此前卫材开发的人源化单抗Farletuzumab、Merck & Endocyte开发的小分子叶酸偶联药物EC145/vintafolide均未达到主要终点(PFS)而失败告终,IMGN853则是在入组人群中发现FRα高表达的亚组患者(占比60%),相比于化疗具有生存权益而死里逃生。从目前的临床数据来看,在接受 ≥ 2.9 mg/kg 治疗的可评估患者中,STRO-002在FRα表达水平不同程度的卵巢癌患者中均表现出持久的反应和抗肿瘤活性。48%(15/31)的患者接受治疗 ≥ 24 周无疾病进展,13%(4/31)继续接受治疗超过一年,这表明 STRO-002 在长期有反应的患者中具有良好的耐受性。相比与IMGN853和MORAb-202仅在FRα阳性的晚期实体瘤表现出抗肿瘤活性,STRO-002作用谱更广。此外,FRα在正常组织中表达较少而在多种实体瘤中过度表达,且不具有靶向毒性。因此,作为Sutro Biopharma的主打管线STRO-002未来可期。
参考资料
1.网页链接
2.网页链接
3.网页链接
声明:以上内容仅供参考,不构成投资建议。
法律声明
本公众号所载信息、意见不构成所述证券或金融工具买卖的出价或征价,估值、盈利预测等分析判断亦不构成对具体证券或金融工具在具体价位、具体时点、具体市场表现的投资建议。该等信息、意见在任何时候均不构成对任何人的具有针对性的、指导具体投资的操作意见,订阅者应当对本公众号中的信息和意见进行评估,根据自身情况自主做出投资决策并自行承担投资风险。
一点基金
一点基金于2021年在广州成立,是专注于二级市场生物医药领域的投资平台,主要投资范围涵盖A股、港股以及美股。注重基本面的深度价值研究,着重自下而上的公司研究,寻求阿尔法