$信立泰(SZ002294)$ 从JK07一期临床试验的剂量爬坡设计中,可以看出药物剂量设计还是很谨小慎微的。五个剂量组分别是0.03mg/kg,0.09mg/kg,0.27mg/kg,0.54mg/kg,1.08mg/kg(根据公司公告,今年只完成前两个剂量组)。这个剂量设计是瞄着Cimaglermin来的,Cimaglermin当时一期临床设计了七个剂量组,分别是0.007mg/kg,0.021mg/kg,0.063mg/kg,0.189mg/kg,0.378mg/kg,0.75mg/kg,1.5mg/kg,前三个被定义为低剂量组,后四个被定义为高剂量组。这些剂量是质量浓度,即每公斤体重含有多少毫克的药物,因为各个药物分子量不同,换算成摩尔浓度对比更直观一些,摩尔浓度可以简单理解为每公斤体重含有药物分子的数量。JK07的分子量在160KD左右,Cimaglermin是全长NRG-1分子,不是只有表皮生长因子(EGF)的活性片段,所以它的分子量比纽卡定大很多,半衰期好很多,依从性好很多,它的分子量是44KD左右,纽卡定只包含EGF活性片段,所以分子量只有6~7KD。这三个分子都换算成摩尔浓度列于下表:
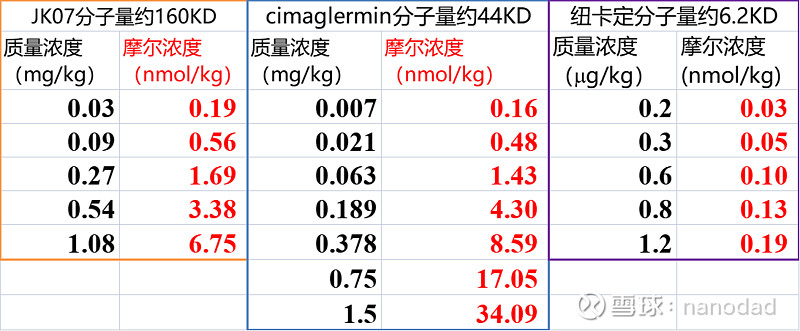 可以看到红色列展示的是摩尔浓度,也就是药物分子数浓度,纽卡定最高剂量所含药物分子数大约相当于JK07和Cimaglermin最低剂量。而Cimaglermin最高剂量换算成分子数浓度则是JK07最高剂量的5倍!恰恰是Cimaglermin最高剂量出了一例肝毒性受试者,所以一期完成后,一直没有进行二期试验。根据它的一期临床试验结果,它的前三个低剂量组不良反应最多是头痛(占比42%),后四个高剂量组不良反应主要是恶心(占比40%),头痛、乏力和腹泻(这三项占比均为27%)。从药物用量上来说,JK07这五个剂量组基本瞄着Cimaglermin前五个剂量,不包含最高的两个剂量,所以判断JK07整体不良反应会少于Cimaglermin。
可以看到红色列展示的是摩尔浓度,也就是药物分子数浓度,纽卡定最高剂量所含药物分子数大约相当于JK07和Cimaglermin最低剂量。而Cimaglermin最高剂量换算成分子数浓度则是JK07最高剂量的5倍!恰恰是Cimaglermin最高剂量出了一例肝毒性受试者,所以一期完成后,一直没有进行二期试验。根据它的一期临床试验结果,它的前三个低剂量组不良反应最多是头痛(占比42%),后四个高剂量组不良反应主要是恶心(占比40%),头痛、乏力和腹泻(这三项占比均为27%)。从药物用量上来说,JK07这五个剂量组基本瞄着Cimaglermin前五个剂量,不包含最高的两个剂量,所以判断JK07整体不良反应会少于Cimaglermin。
这是从药物剂量上来大致判断,另外还要考虑JK07的分子设计优势,NRG-1引起的胃肠不良反应主要是由于HER2/HER3二聚体刺激到胃肠交感神经,而JK07抗体部分对HER3受体有阻断作用,会进一步降低对胃肠的毒性。上面用的摩尔浓度单位是nmol/kg,即每公斤含有的分子数,而考察HER2/HER3二聚体被激活数量的临床前体外细胞实验用的摩尔浓度单位是nmol/L(简写为nM),也就是每升含有的分子数。一升水就是一公斤水,人体80%净重是水,剩下20%主要包含蛋白质、核酸(DNA和RNA)、碳水化合物、脂质和脂肪,人体密度略微大于水一点点,人的1公斤体重所占体积稍稍小于1升,所以这里简化处理,每公斤的分子数约等于每升的分子数。这样我们可以通过临床前的体外细胞实验结果,来大体判断比较纽卡定、Cimaglermin和JK07的临床剂量所诱导激活的HER2/HER3二聚体的量,以此作为依据来判断比较它们的毒性。
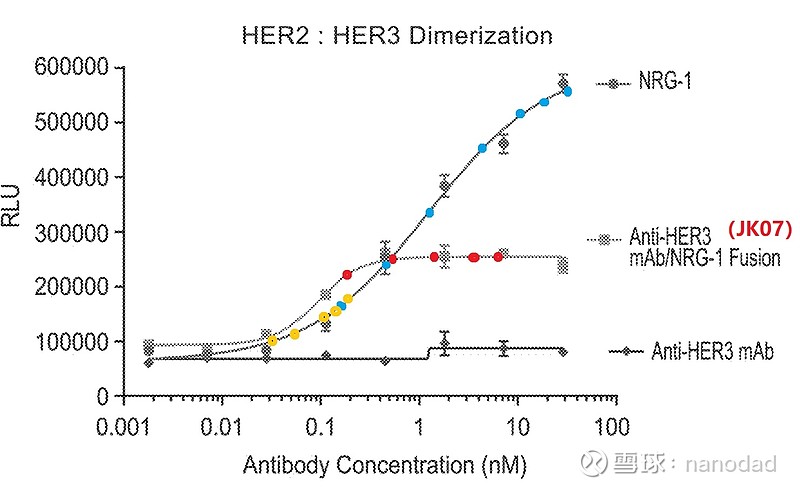 上图可以看出,单纯抗HER3单抗(最下面那条曲线)几乎不诱导激活HER2/HER3二聚体,它的阻断作用还是很强的。JK07那条曲线(中间曲线)上的五个红色点对应五个临床剂量诱导激活的HER2/HER3二聚体的量(药物浓度超过0.4nM之后,被诱导激活的HER2/HER3数量就不再变化了),NRG-1那条曲线(最上面曲线)上七个蓝色点可以看成对应Cimaglermin的七个剂量诱导激活的HER2/HER3二聚体的量,五个黄色点可以看成对应纽卡定剂量诱导激活HER2/HER3二聚体的量。可以看到在低剂量时,JK07前两个剂量比Cimaglermin前两个剂量激活HER2/HER3二聚体的量稍微多一点,但是随着药物浓度增加,高剂量的JK07激活HER2/HER3二聚体的量明显应该小于Cimaglermin了,原因应该归于越来越多的JK07单抗部分结合HER3,从而阻断HER2和HER3结合形成二聚体,所以推断高剂量组JK07产生的胃肠毒性是明显小于Cimaglermin的。
上图可以看出,单纯抗HER3单抗(最下面那条曲线)几乎不诱导激活HER2/HER3二聚体,它的阻断作用还是很强的。JK07那条曲线(中间曲线)上的五个红色点对应五个临床剂量诱导激活的HER2/HER3二聚体的量(药物浓度超过0.4nM之后,被诱导激活的HER2/HER3数量就不再变化了),NRG-1那条曲线(最上面曲线)上七个蓝色点可以看成对应Cimaglermin的七个剂量诱导激活的HER2/HER3二聚体的量,五个黄色点可以看成对应纽卡定剂量诱导激活HER2/HER3二聚体的量。可以看到在低剂量时,JK07前两个剂量比Cimaglermin前两个剂量激活HER2/HER3二聚体的量稍微多一点,但是随着药物浓度增加,高剂量的JK07激活HER2/HER3二聚体的量明显应该小于Cimaglermin了,原因应该归于越来越多的JK07单抗部分结合HER3,从而阻断HER2和HER3结合形成二聚体,所以推断高剂量组JK07产生的胃肠毒性是明显小于Cimaglermin的。
体内临床前试验,实验对象是猴子,一次给药JK07的剂量高达10、30、60mg/kg,连续给药剂量也高达3、10、30mg/kg,远远高于一期最高剂量(1.08mg/kg),结果是未发现严重的肠胃毒性反应,真是拿猴子当实验品啊!
现在可以对JK07的NRG-1部分做个推断:JK07五个剂量相对Cimaglermin七个剂量组少了两个最高剂量,不良反应预计会减少,安全性提高了。而根据临床前体外细胞实验结果,JK07除前两个最低剂量诱导激活的HER2/HER3二聚体比Cimaglermin最低的两个剂量稍微多一点以外,更高剂量诱导激活的HER2/HER3二聚体要远小于Cimaglermin所诱导激活的量,这就又多了一层安全性保护。
分析到这里,另一个问题该考虑了,那就是JK07的抗体部分会带来怎样的毒副作用?因为Cimaglermin和纽卡定都没有抗体部分,所以不具备参考意义。那我们就需要考察纯抗HER3单抗部分,这个单抗实际上是靶向HER3受体的抗癌药物,最早的两款靶向HER3的单抗分别是第一三共的patritumab和MERRIMACK制药公司的seribantumab,这两个药都在二期失败了,原因是未达到无进展生存期(PFS)的主要终点,属于有效性问题,并不是安全性问题。patritumab的临床剂量是18mg/kg,seribantumab的临床试验剂量是20mg/kg和40mg/kg,这里不用再换算成摩尔浓度了,因为单抗基本上就是免疫球蛋白,分子量差不多,只是在可变区有变化,直接对比质量浓度就行了。虽然patritumab失败了,但是第一三共没有放弃,又拿它偶联药物,做了一款ADC,现在在二期试验,据说效果不错,适应症为EGFR突变的非小细胞肺癌。那么这款ADC的药物剂量是多少呢?目前这款ADC在二期临床试验中,剂量为3.2mg/kg,4.8mg/kg,6.4mg/kg。这几个药物的临床剂量比JK07都大,JK07最大是1.08mg/kg,再加上JK07重链部分做了基因突变减弱了ADCC效应,因此单抗部分的毒副作用也是可以谨慎乐观看待的。
综上,通过分析,JK07整体的安全性是可以谨慎乐观看待的,当然这些分子设计、临床前实验、以及和其他相似药物临床安全性试验对比,都代替不了本身的临床试验,连同一个药物在不同地方上市都要做桥接实验,何况不同药物呢?真正的安全性数据还是需要等到一期数据揭盲,中美临床科学家们对待这款药物很谨慎,病人筛选很严格,不希望为了进度而让安全性受到其他因素干扰,因此耐心等待吧,希望到时会得到非常理想的JK07一期临床安全性数据!最终受益的会是心衰患者!