人类疾病相关的蛋白靶点中约85%为难成药靶点,除了KRAS之外,还有c-myc,p53等经典难成药靶点,迫切需要新的药物发现技术和机制,如蛋白降解、基因编辑、人工智能(AI)制药、靶向 RNA 调控、相分离等。
本文,我们一起来了解突破难成药靶点的策略。
什么是难成药靶点?
人类疾病相关的蛋白靶点中约15%为相对容易成药的靶点,它们具有适合的结合位点和明确的活性位点,而剩下的85%为难成药的靶点,是指缺乏明确的结合口袋、缺乏功能明确的配体或者内源性底物的亲和力过高且通过传统方法“难以成药”或“尚未成药”的但具有临床意义的治疗靶点。
难成药靶点常具有以下特点:
1. 具有扩展和平坦的功能界面,缺乏明确的配体结合口袋;
2. 缺乏特定配体来使得靶蛋白发挥功能;
3. 该靶点是疾病抑制剂,需要药物激活蛋白质活性,使得药物开发更具挑战性;
4. 不可成药靶点常具有复杂的生理功能,增加了药物设计和开发的难度;
5. 药物开发策略的限制。
典型的不可成药靶点主要包括以下几类:
1. 转录因子,如 STAT,c-myc 和 p53;
2. GTP酶,如RAS家族蛋白KRAS;
3. 内在无序蛋白质,如Tau蛋白;
4. 蛋白与蛋白互相作用,如抗凋亡家族蛋白Bcl2;
5. 磷酸酶,如SHP2(图1)[1]。
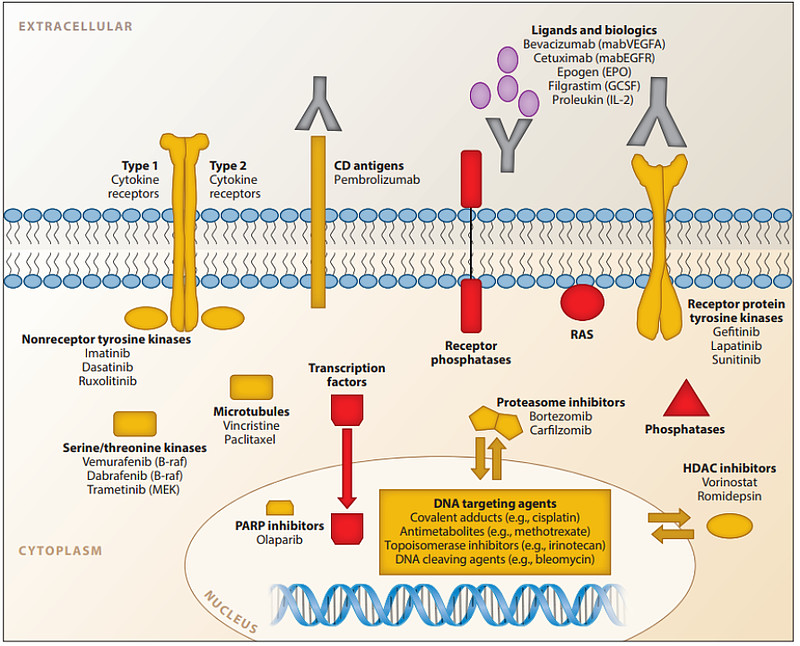
图1. 癌症药物分子靶点的示意图(红色表示难成药靶点)
针对这些难成药靶点,新的技术和药物形式迫切需要,如蛋白降解剂、基因治疗和AI制药等。
01 蛋白降解剂
蛋白降解剂是一类可利用细胞内固有的蛋白质降解途径来靶向蛋白质降解减少特异的细胞蛋白,是一种靶向“不可成药”的突破性药物研发策略。
蛋白降解剂包括多种类型,如PROTAC、分子胶、LYTAC、ATAC、AbTAC、ATTEC、AUTAC、AUTOTAC等,其中PROTAC、分子胶是较为成熟、研究最多的两种类型(图2)[2]。
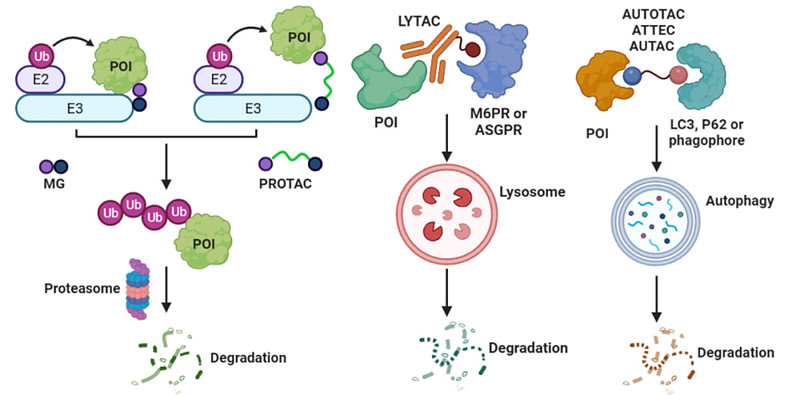
图2. 蛋白降解剂作用机制
PROTAC
PROTAC是一种能特异性结合靶蛋白同时招募E3泛素连接酶并使靶蛋白(POI)多聚泛素化、最终通过泛素-蛋白酶体途径降解胞内致病蛋白的双功能分子。
与小分子或抗体相比,PROTAC药物是催化机制,催化剂量即可触发降解,不需要直接抑制目标蛋白的功能活性,不需要与目标蛋白长时间和高强度的结合,对于没有活性位点的支架蛋白等不可成药靶点同样具有作用潜力,因此PROTAC具有可靶向“不可成药”靶点的优势。
目前临床上有二十多款PROTAC药物在研,不过大部分药物都是针对成药靶点,其中Arvinas的用于治疗ER阳性/HER2阴性乳腺癌的ARV-110进展最快,目前处于临床3期,而针对难成药靶点的药物大多处于临床前或临床早期开发阶段,如临床1期的Bcl-xl降解剂DT-2216。
此前几十年,KRAS一直被认为是难成药靶点,直到Sotorasib和Adagrasib的上市才打破这个僵局,但是Sotorasib和Adagrasib的市场之路并不顺利。
Sotorasib上市之后销售额达不到预期,去年10月更是被83%(10/12)FDA ODAC(肿瘤药物咨询委员会)专家组认为由于系统性偏倚问题,Sotorasib的Ⅲ期验证临床CodeBreak 200主要终点PFS获益的可靠性不足,sotorasib或将面临退市。
基于此,KRAS PROTAC或许是一个更好的选择,近期,中国国家药监局药品审评中心(CDE)官网公示,安斯泰来申报的新型KRAS G12D蛋白降解剂ASP3082注射液获批临床,拟开发用于携带KRAS G12D突变的既往经治局部晚期(不可切除)或转移性恶性实体瘤。
分子胶
PROTAC是由E3连接酶配体和目标蛋白配体组成,通过化学接头连接,然后以三元复合物的形式诱导两种蛋白质接近,而分子胶与PROTAC的区别在于分子胶没有接头,它通过诱导、稳定或增强两种蛋白质之间相互作用,可以与两种蛋白质中的一种结合,而不能与另一种结合,拉近靶蛋白和E3连接酶的距离,并诱导靶蛋白的泛素化和降解,与PROTAC相比分子胶是分子量较小(图4)。
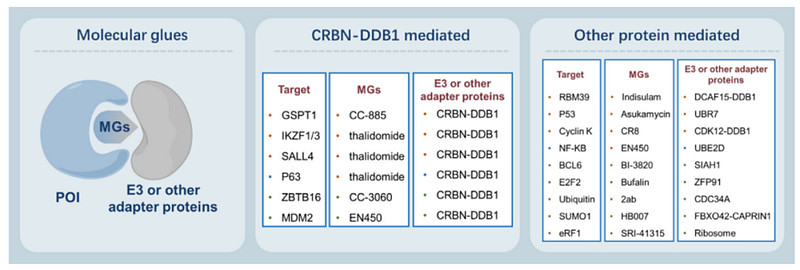
图4. 分子胶靶向难成药靶点
02 基因治疗
从生物学角度出发,当靶向蛋白质的靶点难以或者无法成药时,科学家们开始沿着中心法则上游出发,通过靶向DNA或RNA的基因疗法来解决“不可成药”难点。
基因治疗是在基因或转录水平来调节基因表达的过程,突破了小分子药物对靶蛋白位点的限制,大大扩展了药物靶向的范围。
基因治疗的方式大体分为以下三种:
一是将正常基因运输到患者体内细胞以替代突变基因;
二是激活或敲除细胞内功能异常的突变基因;
三是导入新基因到体内以治疗相应疾病。
基因治疗药物主要包括质粒DNA、病毒载体治疗药物、细菌载体基因治疗药物、基因编辑治疗药物、患者来源的细胞基因治疗产品等(图5)[3]。
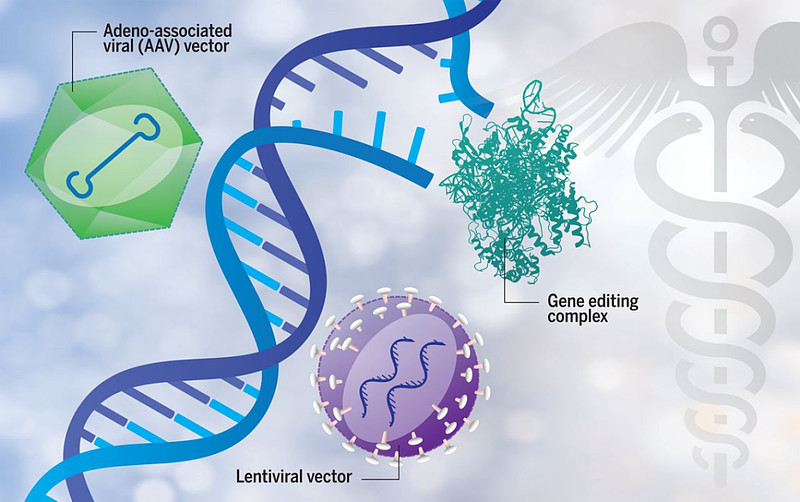
图5. 基因治疗方式
靶向c-Myc mRNA的小分子调控剂(rSM)
转录因子Myc蛋白(又称c-Myc)是一种固有无序蛋白,单独的Myc蛋白没有稳定的构象和适合小分子结合的位点,也是难成药代表性靶点。Myc蛋白自身稳定性较差,只有结合Max后才具有稳定构象,形成Myc-Max复合物后,与DNA上的E-box序列结合启动下游基因转录[4]。
直接靶向Myc蛋白有一定难度,因此,除了直接靶向Myc通路的Myc-Max相互作用和抑制Myc-Max复合物与DNA的相互作用外,间接调控Myc上下游通路也是治疗Myc相关疾病的重要方法,如Arrakis Therapeutics有一款靶向c-Myc mRNA的小分子,通过抑制c-Myc蛋白的表达,从而阻断Myc的功能,目前该项目正处于早期开发阶段(图6)。

图6. Arrakis Therapeutics的部分在研管线
mRNA 药物OTX-2002降低MYC表达
Omega Therapeutics 正在开发一种基于 mRNA 的药物OTX-2002,此药物为通过脂质纳米颗粒(LNP)递送的mRNA治疗物,可在MYC基因转录以前,通过调节表观基因组来降低MYC的表达。OTX-2002已于2022年7月进入临床1/2期试验(图7)。

图7. Omega Therapeutics的部分在研管线
最初基因治疗仅被用于遗传性疾病的治疗,而现在正被广泛用于肿瘤、感染性疾病、心血管疾病和自身免疫性疾病的治疗,如CAR-T细胞免疫疗法。
截止目前,全球有几十种基因疗法的药物获批上市。随着技术的发展,基因编辑的应用越来越成熟广泛,目前CRISPR/Cas9应用最为广泛。
与RNA干扰(RNAi)相比,CRISPR/Cas9可以靶向DNA并改变或敲除基因表达而不是在转录后水平降低基因表达,可以提高抑制基因表达的效率。
除此之外,CRISPR/Cas9技术还有靶向精确性更高、无物种限制和可实现对多个靶点同时敲除等优点。
03 AI制药
除此之外,靶向“不可成药”靶点的潜在途径还有基于数据和算法的方式,比如近几年比较火热的人工智能(AI)和深度学习等。
科学家可以通过数据和AI算法实现蛋白质结构预测或者辅助抗体等蛋白质药物的设计,挖掘新的化合物空间或抗原表位,使不可能发现的靶点及成药机制成为可能,拓展用于药物研发的初始蛋白结构库,创造新的药物方向及增量市场,而且可以通过数据集找出一些合成致死靶点配对,通过靶向某个难成药靶点的合成致死配对来破解不可成药。
随着技术的发展,AI算法也得到很大的进步,近期,Alphabet在荣登Science杂志公布2021年度科学突破榜单榜首AlphaFold 2 的基础之上推出新一代AI生物分子结构模型AlphaFold 3,将预测范围从蛋白质带到广泛的生物分子,如DNA、RNA、配体小分子、离子和修饰残基在内的复合物的联合结构。
近几年,AI制药概念风靡,全球有多款在研的AI制药药物,如临床2期的LP-300、LAM-001、REC-2282和NX-13等,其中也有很多药物针对难成药靶点,如GDC-1971(RLY-1971)。
GDC-1971
GDC-1971是由Relay Therapeutics研发的一种口服、小分子、有效和选择性的蛋白酪氨酸磷酸酶SHP2变构抑制剂,结合并稳定SHP2的非活性构象(图8)[6]。
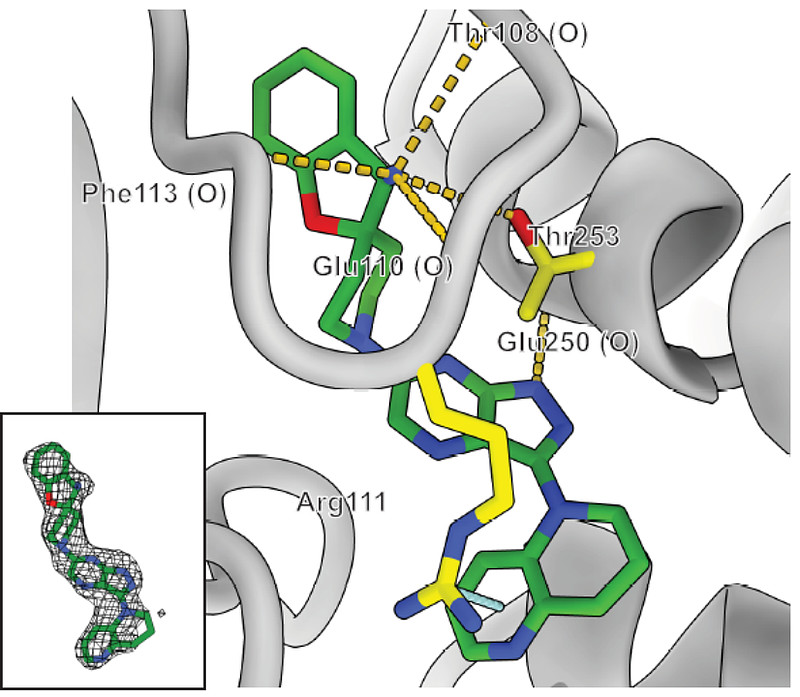
图8. GDC-1971与SHP2结合构象
2020年12月,基因泰克与Relay就 GDC-1971 的开发和商业化签订了全球许可和合作协议。Relay公司收到750万美元的首付款和2500万美元的近期付款,基因泰克开展了一项GDC-1971与divarsib(KRASG12C抑制剂)联合治疗KRAS依赖性实体瘤的临床I期试验(NCT04449874)。
AI制药研发火热,全球有多家专门成立的AI制药公司,如国外的Exscientia、BenevolentAI、Relay Therapeutics、Recursion Pharmaceuticals、国内的晶泰科技、英矽智能和深势科技等。
晶泰科技
晶泰科技于2015年在深圳成立,是一家以人工智能和机器人驱动的创新研发平台, 其首创的ID4Inno™是以智能计算、自动化实验及专家经验相结合的“三位一体”AI药物发现新范式,以更高的效率、更低的成本探索更广阔的化学空间(图9)。
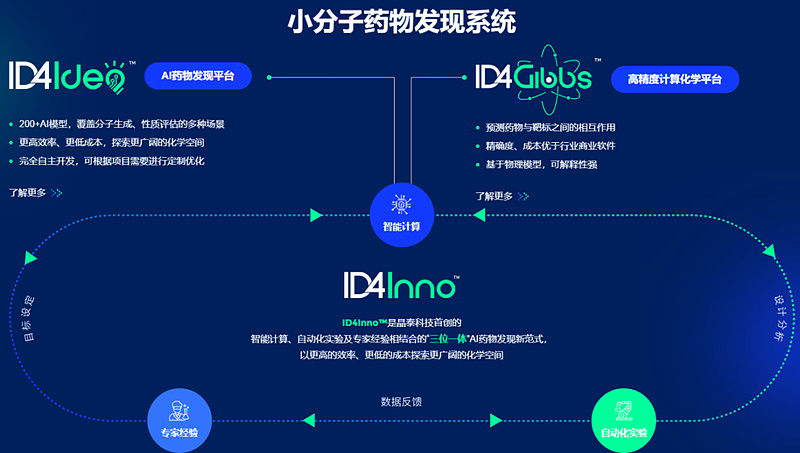
图9. 晶泰科技的小分子药物发现系统
6月13日,晶泰科技(02228.HK)在港交所上市,成为中国AI制药第一股。作为首家以港交所18C规则上市的科技公司,晶泰科技亦是18C第一股。
英矽智能
英矽智能最早于2014年成立,目前已在六个国家和地区建立了办公室和研发团队,在全球拥有200多名员工,并于2019年06在上海成立中国公司。
英矽智能主要通过自主研发的生成对抗网络 (GANs)、深度强化学习 (RL)、预训练模型 (Transformer) 以及其他机器学习技术,构建了一个人工智能药物研发平台,其AI平台建立在生成式AI的基础上,包括靶点发现平台PandaOmics,分子生成平台Chemistry42和临床试验结果预测平台inClinico。
英矽智能有多款药物进入临床,如临床2期治疗特发性肺纤维化药物ISM001-055、临床1期的治疗炎症性肠病药物ISM-5411以及临床1期治疗晚期恶性实体瘤药物ISM-8207等。
深势科技
深势科技是一家成立于2019年的AI制药企业,其自主开发的RiDymo强化动力学平台可以对蛋白动态构象进行充分采样,探索全新的隐藏/别构口袋,诱导形成可药口袋,助力难成药靶点的理性开发(图11)。
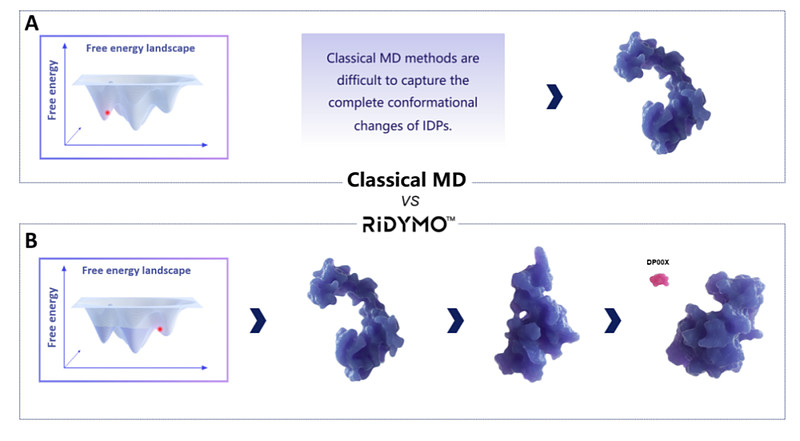
图11. RiDymo强化动力学平台
04 写在最后
人类蛋白质组尚有大量与疾病相关的蛋白靶点有待挖掘,新的技术和手段有助于新药的发现,PROTAC、基因治疗以及AI制药都是有潜力的靶向不可成药靶点的手段,除此之外,共价抑制剂、变构抑制剂等也是靶向不可成药靶点潜力途径。
Ref.
1.John S. Lazo and Elizabeth R. Sharlow, Drugging Undruggable Molecular Cancer Targets, Annu. Rev. Pharmacol. Toxicol. 2016. 56:23–40
2.Chao Zhang, et.al,Targeting the undruggables—the power of protein degraders,Science Bulletin
3.Cynthia E Dunbar et.al, Gene therapy comes of age, Science. 2018 Jan 12;359(6372):eaan4672.
4.Sarah K. Madden et.al, Taking the Myc out of cancer: toward therapeutic strategies to directly inhibit c-Myc, Madden et al. Molecular Cancer (2021) 20:3
5.Orchard Therapeutics Receives FDA Approval of Lenmeldy™ (atidarsagene autotemcel), the Only Therapy for Eligible Children with Early-onset Metachromatic Leukodystrophy in the U.S.
6.Alexander M. Taylor, Identification of GDC-1971 (RLY-1971), a SHP2 Inhibitor Designed for the Treatment of Solid Tumors, J. Med. Chem. 2023, 66, 13384−13399
文章来源:Big生物创新社 医药速览:突破难成药靶点的几个策略