$Beam Therapeutics(BEAM)$ 我们是一家生物技术公司,致力于基于我们专有的基础编辑技术来创建一类新型的精密基因药物,其愿景是为患有严重疾病的患者提供终生治疗。我们专有的碱基编辑技术有可能实现一类全新的精准基因医学,其靶向基因组中的单个碱基而不会在DNA中造成双链断裂。这种方法使用化学反应,旨在在目标序列上产生精确,可预测和有效的遗传结果。我们新颖的碱基编辑器具有两个主要成分:(i)与引导RNA结合的CRISPR蛋白,可利用CRISPR建立的DNA靶向能力,但经过修饰不会引起双链断裂,以及(ii)碱基编辑酶,例如脱氨酶,可以对目标DNA碱基进行所需的化学修饰。我们相信,与传统的基因编辑方法相比,这种设计有助于更精确,更有效的编辑。我们的编辑人员的精确度有可能增加基因编辑对广泛治疗应用的影响。通过相信基因医学领域最近的重大进步,我们相信我们将能够迅速提高我们新颖的碱基编辑程序的组合。
现有的基因编辑技术通过在DNA中产生靶向的双链断裂,然后依靠细胞机制来完成编辑过程。这种方法可以有效地破坏基因表达。但是,它们不能精确修复或改变基因序列,并可能导致不需要的DNA修饰。我们相信我们的基础编辑平台比现有的基因编辑和基因治疗方法具有重要的优势,包括:
•
高度精确且可预测的基因编辑,旨在仅在所需目标位置进行一种类型的基础编辑
•
高效和治疗相关的基因校正水平,通常是基于核酸酶的方法无法实现的
•
在包括分裂和非分裂细胞在内的各种细胞类型中具有广泛的适用性
•
直接对DNA进行化学修饰,无需交付校正的DNA序列
•
避免与双链断裂相关的有害DNA修饰,包括基因破坏和染色体重排,例如易位或缺失
•
永久性编辑基因,创造了终身治疗结果的潜力,包括治疗婴儿或幼儿的能力,因为随着孩子的成长,该编辑将通过分裂细胞来传递
•
通过在其天然基因组环境中修饰基因来保留细胞中的自然调节和正常数量的基因
•
多功能和模块化的产品引擎,可以使用相同的碱基编辑器和不同的指导RNA靶向不同的基因序列
我们目前正在针对不同的编辑目标推进基础编辑程序的广泛,多元化的组合。为了充分发挥我们的基础编辑技术在各种治疗应用中的全部潜力,我们正在并行开发一套全面的经过临床验证的交付方式。对于给定的组织类型,我们使用具有最引人注目的生物分布的传递方式。我们的计划按递送方式分为三个不同的管道:电穿孔以有效地离体递送至血细胞和免疫细胞;用于非病毒体内的脂质纳米颗粒或LNP将来输送至肝脏和其他潜在器官;以及与腺相关的病毒载体,即AAV,用于将病毒输送到眼睛和中枢神经系统或中枢神经系统。
我们的基本编辑产品组合
基本编辑方法的优雅和简单提供了一个高效,精确和高度通用的基因编辑系统,能够进行基因校正,基因沉默/基因激活以及同时对多个基因进行多重编辑。我们相信我们的基础编辑者的灵活性和多功能性可能会导致广泛的治疗适用性和在精密遗传医学领域的转化潜力。
我们已通过在小鼠中长期植入离体碱基编辑的人CD34细胞获得BEAM-101的体内概念验证,该程序可重现具有胎儿血红蛋白或HPFH遗传性持久性的个体的单碱基变化,保护他们免受引起镰状细胞病或地中海贫血的突变的影响。此外,在2020年第二季度,
18
我们在BEAM-102上发布了数据,该程序可通过重建天然存在的人类血红蛋白变体Hb-G Makassar 来直接纠正镰状细胞病的致病突变。望加锡变种不会引起血红蛋白聚合或红细胞镰刀化,因此,通过消除致病蛋白可以使编辑过的细胞得以治愈。关于我们的肝脏疾病计划,同样在2020年第二季度,我们已经显示出能够直接纠正导致α-1抗胰蛋白酶缺乏症的突变的能力,可以在体内和体外提供基础编辑以纠正这种疾病的概念证明。我们还成功地展示基地编辑可行性与各相关细胞类型的电穿孔和AAV和我们的三个交付模式的体内心肌梗死CE的携号转网。
除了已经建立的体内概念验证之外,我们希望在2020年实现更多的里程碑,包括发布其他体内基础编辑数据,并且前提是COVID-19大流行不会导致我们的时间表大幅度下滑,研究性新药,即IND,可用于我们至少一项牵头计划的研究。我们希望从该投资组合中提交首批IND申请,我们仍有望在2021年提交首份IND。
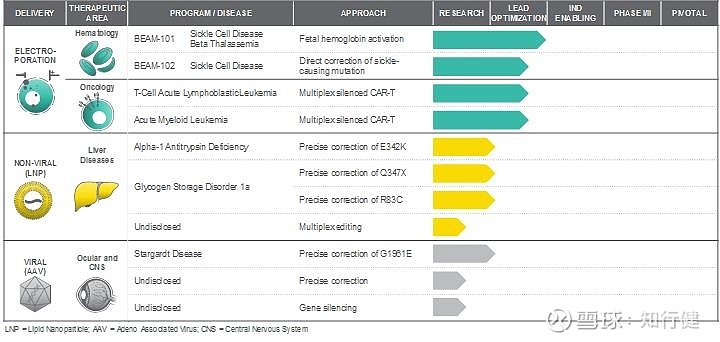
我们平台的模块化意味着使用特定的交付方式建立基础编辑的临床前概念验证也将潜在地降低风险并加快我们针对相同组织开发的其他候选产品的时间表。在某些情况下,候选新产品可能只需要更改指导RNA。使用相同交付方式的后续程序也可以利用早期程序的共享功能和资源。通过这种方式,我们将每种交付方式视为其自己独特的渠道,其中任何一个程序的成功都可能为大量其他程序快速进入临床铺平道路。
体外电穿孔治疗血液系统疾病和肿瘤
镰状细胞病和β地中海贫血
镰状细胞病是一种严重的遗传性血液病,是由β珠蛋白基因第六个氨基酸处的单点突变E6V引起的。这种突变导致血红蛋白或HbS的突变形式聚集为长而刚性的分子,这些分子在低氧条件下将红细胞弯曲成镰刀状。病态的细胞阻塞血管并过早死亡,最终导致贫血,严重疼痛(危机),感染,中风,器官衰竭和早期死亡。镰状细胞病是美国最常见的遗传性血液病,估计影响100,000个人,其中很大一部分是非裔血统(1:365出生)。β地中海贫血是另一种遗传性血液疾病,其特征在于严重的贫血,这是由于β珠蛋白表达不足引起的功能性血红蛋白生成减少所致。输血依赖型β地中海贫血(TDBT)是该疾病的最严重形式,每年通常需要多次输血。TDBT患者无法健壮,持续感染和危及生命的贫血。全球有症状的β地中海贫血的发生率估计为1:100,000,其中欧洲为1:10,000。在美国,基于100,000例新生儿中0.7例的出生率,以及成活率的提高,我们预计受此疾病影响的人数将超过1,400人,并且还在上升。对于镰状细胞病或β地中海贫血患者,目前唯一可用的潜在治疗方法是同种异体造血干细胞移植或HSCT。但是,这种方法的风险很高,尤其是移植物抗宿主病或GvHD,导致选择这种治疗的患者人数很少。
19
我们正在使用基础编辑来寻求两种互补的方法来治疗疾病性le细胞疾病,另一种方法来治疗β地中海贫血:
•
激活胎儿血红蛋白的差异化方法,可用于镰状细胞病和β地中海贫血的治疗(BEAM-101);和
•
直接校正镰刀突变的新方法(BEAM-102)。
BEAM-101:重建自然发生的保护性突变以激活胎儿血红蛋白
胎儿形式的血红蛋白或HbF补偿成人血红蛋白突变的有益作用首先在患有HPFH的个体中发现。携带突变的人通常会导致他们成为β地中海贫血或镰状细胞病患者,但也患有HPFH,无症状或经历了轻度疾病。HPFH是由基因HBG1和HBG2调节区域的单碱基变化引起的,它阻止一种或多种阻遏蛋白的结合并增加形成HbF四聚体一部分的γ珠蛋白的表达。
使用碱基编辑,我们在γ珠蛋白基因的调控元件中重现了这些特定的,自然发生的碱基变化,从而阻止了阻遏蛋白的结合并导致了γ珠蛋白表达的重新激活,从而导致了γ珠蛋白水平的增加。我们使用离体递送对BEAM-101进行了体外和体内表征,从而实现了对人类CD34 +造血干细胞和祖细胞或HSPC的精确而高效的编辑,从而导致了小鼠长期植入并与治疗相关的靶基因表达增加。
BEAM-101的体外表征:
•
我们证明了在体外健康供体CD34细胞中> 90%的编辑。
•
我们证明了类红细胞分化后的γ球蛋白上调与编辑率高度相关(R 2 = 0.993),其中> 90%的编辑我们在健康供体CD34 +细胞中实现了γ球蛋白增加> 60%。
•
来自纯合镰状细胞病患者的CD34 +细胞的成功编辑,证明体外分化后,γ珠蛋白水平增加了60%以上,同时镰刀β球蛋白水平减少了不到40%。
BEAM-101的体内性能:
•
我们证明,来自健康人类供体的编辑过的CD34 +细胞高度嵌合,并在免疫受损的小鼠中16周后保持> 90%的编辑。
•
我们在植入16周后证明,碱基编辑的细胞可成功完成多谱系重构,在分类的人类HSPC,髓样,淋巴样和红系细胞中可实现> 90%的碱基编辑。
•
我们在植入后18周时用第二位供体的细胞复制了这些发现。
BEAM-102:镰状细胞突变的直接校正
我们针对镰状细胞疾病的第二种基本编辑方法BEAM-102是对β珠蛋白基因6位上的镰状突变的直接校正。通过进行一次从A到G的编辑,我们已经在从镰状细胞病患者中分离出的原代人CD34 +细胞中证明了创建天然存在的血红蛋白望加锡变体的能力。该变体最初于1970年在人类中发现,具有与野生型变体相同的功能,不会引起镰状细胞病。与其他方法不同,以这种方式成功编辑的细胞将被完全纠正,不再包含镰刀蛋白。
BEAM-102使用我们的腺嘌呤碱基编辑器(ABE)的离体递送来编辑CD34 + HSPC。 在从镰状细胞性疾病的供体中分离出的细胞中,在体外红系分化后,我们将镰状点突变校正为HbG-Makassar变异的80%以上。如预期的那样,我们观察到HbS的同时降低至控制水平的20%以下。超过70%的来自经过编辑的患者细胞的类红细胞集落显示出双等位基因编辑(产生的细胞不再产生任何镰刀蛋白),有20%的单等位基因编辑(具有1个镰刀等位基因和1个校正的等位基因,可能赋予一定的保护水平类似于没有明显疾病症状的“镰状细胞性状”患者,其中2%未编辑。此外,显示将HbS蛋白校正为HbG-Makassar变体可显着降低HbS蛋白的倾向。缺氧时体外分化的红系细胞会镰状化。这些发现代表了治疗水平的校正,并支持该计划的进展,以潜在地解决镰状细胞疾病的潜在遗传原因。已发表的模型研究表明,仅校正20%的HbS可能足以治愈该疾病。
离体电穿孔用于高级细胞疗法的多重编辑
免疫学/肿瘤学中的CAR-T细胞疗法
我们认为碱基编辑是一种理想的工具,可同时对许多基因进行多重编辑而不会产生意料之外的靶标效应,例如基因组重排或p53途径的激活,这可能是由于通过创建双链断裂而同时进行核酸酶编辑而引起的。在T细胞中创建大量多重编辑的能力可以赋予CAR-T细胞和其他
20
具有多种功能组合的细胞疗法,可以显着增强其在治疗血液学或实体瘤中的治疗潜力。
概念验证实验现已证明,碱基编辑器可以同时有效修饰原代人T细胞中多达8个基因组位点的能力,其效率范围为85-95%(通过靶蛋白敲低的流式细胞仪测量)。重要的是,这些结果是通过敏感方法(UDiTaS TM)检测到的,而不会产生染色体重排,并且不会因编辑而丧失细胞活力。概念验证实验还证明了对目标肿瘤细胞的强大的T细胞杀伤。
我们最初的重点将放在血液系统恶性肿瘤上,我们正在开发均具有四个编辑功能的同种异体CAR-T产品候选物。这种多重编辑将实现高度的工程设计和功能,包括以下同时进行的编辑:
•
防止移植物抗宿主。消除现有的TCR,以确保CAR-T细胞仅攻击肿瘤上的CAR抗原,而不攻击患者的健康细胞。
•
启用同种异体细胞来源。允许使用健康供体细胞的另一种编辑方式。
•
最小化肿瘤微环境的干扰。另一种编辑方法,可最大程度地减少T细胞的疲惫并延长攻击肿瘤的功效。
•
预防杀菌。进行其他修改以消除恶性细胞和CAR-T细胞之间共享的抗原,以防止杀人(例如,CAR-T细胞在攻击肿瘤之前会相互攻击)。
我们计划针对这些候选产品的最初指征是复发性,难治性,小儿T细胞急性淋巴细胞白血病或T-ALL,以及小儿急性髓细胞白血病或AML。我们相信,与现有方法相比,我们的方法有可能产生更高的响应率和更深的缓解。
肝病的非病毒输送
Alpha-1抗胰蛋白酶缺乏症
Alpha-1抗胰蛋白酶缺乏症或Alpha-1是一种严重的遗传性疾病,可导致进行性肺和肝疾病。当患者的342个氨基酸的SERPINA1基因的两个拷贝都具有点突变(E342K,也称为PiZ突变或“ Z”等位基因)时,会出现ALPHA-1的最严重形式。该点突变导致alpha-1抗胰蛋白酶或AAT错折叠,在肝细胞内部积累而不是被分泌,导致循环AAT的水平非常低(10%-15%)。结果,肺部不受中性粒细胞弹性蛋白酶的保护,导致肺部进行性,破坏性改变,例如肺气肿,这可能导致需要进行肺移植。突变的AAT蛋白也积累在肝脏中,引起肝脏炎症和肝硬化,最终可能导致肝衰竭或癌症,并要求患者进行肝移植。据估计,在美国大约有60,000个人拥有Z等位基因的两个副本。目前尚无针对ALPHA-1患者的治疗方法。
凭借我们的基础编辑器的高效率和高精度,我们旨在利用我们的ABE实现A-to-T和G-to-C碱基对的可编程转换,并精确地将E342K点突变纠正回野生型序列。
对于最近的研究,我们设计了新颖的ABE并指导能够纠正PiZ突变的RNA,然后应用专有的非病毒脂质纳米颗粒制剂将优化的试剂递送至PiZ转基因小鼠模型的肝脏。这种直接编辑的方法在7天时平均对有益等位基因的校正为16.9%,在三个月时平均为28.8%。在此期间的显着增加表明,校正后的肝细胞相对于未校正的细胞可能具有增殖优势。此外,经过治疗的小鼠在三个月内显示出肝脏中的α-1抗胰蛋白酶或A1AT球蛋白含量降低,并且血清A1AT活性蛋白持久,显着增加,比对照组高约4.9倍,我们认为这将是如果在患者中达到治疗效果。
糖原贮积病1a
1A型糖原贮积病,也称为冯·吉尔克病,是由G6PC基因突变引起的先天性葡萄糖代谢紊乱,如果患者不遵守严格的慢速治疗方案,则会导致低血糖水平,这可能是致命的-释放形式的葡萄糖,每1-4小时(包括过夜)给药。对于GSD1a患者,尚无可改善疾病的疗法。
我们治疗糖原贮积病1a或GSD1a的患者的方法是通过LNP传递进行碱基编辑,以修复引起该病的两个最普遍的突变R83C和Q347X。据估计,在美国,这些两点突变分别占900和500名患者,约占所有GSD1a患者的59%。动物研究表明,肝细胞中正常G6Pase活性的低至11%足以恢复空腹血糖。但是,必须保持该水平以保持血糖控制并缓解其他严重的,可能致命的GSD1a后遗症
21
我们已经确定了候选产品,可以纠正带有Q347X点突变的细胞中多达80%的等位基因,以及带有R83C突变的细胞中约60%的等位基因,如下图所示。预期至少11%的校正与GSD1a患者在临床上相关,并且可能会改变疾病。
眼部和中枢神经系统疾病的病毒传递
斯塔加特病
Stargardt病是视网膜中央区域的遗传性疾病,通常在青春期开始引起进行性视力丧失,最终导致中央和夜视失明。导致Stargardt病的ABCA4基因中最普遍的突变是G1961E点突变。在美国,大约有5500个人受到此突变的影响。我们的基本编辑方法是修复ABCA4基因中的G1961E点突变。使用微小斑点刺激或通过孔的光刺激等效于单个感光细胞的疾病模型表明,这些细胞中只有12%-20%足以保留视力。因此,我们预计,这些细胞的12%-20%范围内的编辑百分比会缓解疾病,
假设基本编辑器大于单个AAV的包装容量,我们使用一个拆分式AAV系统,该系统通过两个AAV向量提供基本编辑器。进入单元后,将编辑器的两半重新组合以创建功能基本编辑器。在我们已敲除ABCA4 G1961E点突变的人视网膜色素上皮细胞系(ARPE-19细胞)中,我们证明了 用分裂AAV双重感染后5周时,精确校正了约75%的疾病等位基因系统。
协同合作
我们相信我们的基础编辑技术在广泛的遗传疾病中具有潜力。为了充分发挥这种潜力,我们已经建立并将继续寻求与先驱公司以及领先的学术和研究机构的创新合作,许可证和战略联盟。此外,我们已经并且将继续寻求可能使我们加快临床前研究和开发工作的关系。这些关系将使我们秉承最大程度地发挥基础编辑潜力的愿景,从而为患有严重疾病的患者提供终身治疗。
体外电穿孔治疗血液系统疾病和肿瘤
波士顿儿童医院
2020年7月,我们与波士顿儿童医院结成了战略联盟。根据该协议的条款,我们将赞助波士顿儿童医院的研究计划,以利用我们专有的基础编辑技术促进针对特定疾病的疗法的开发。波士顿儿童医院还将作为临床站点,在某些感兴趣的治疗领域推进我们的临床研究工作从台到床的翻译,包括镰状细胞疾病和小儿白血病的计划以及针对其他疾病的新计划的探索。
洋红色疗法
2020年6月,我们宣布与Magenta Therapeutics达成一项非排他性研究和临床合作协议,以评估MGTA-117(Magenta新型靶向ADC用于治疗接受我们的基础编辑疗法的镰状细胞疾病和β地中海贫血患者)的潜在效用。调理是使患者的身体准备好接受编辑后的细胞所必需的关键组成部分,这些细胞带有校正后的基因,必须植入患者的骨髓中才能有效。当今的调理方案依赖于非特异性化学疗法或放射疗法,这与明显的毒性有关。MGTA-117仅精确地靶向造血干细胞和祖细胞,保留了免疫细胞,并且在非人类灵长类动物模型中显示出高选择性,有效功效,广泛的安全系数和广泛的耐受性。MGTA-117可能能够清除骨髓中的空间,以支持患者的长期植入和快速恢复。将我们的基础编辑技术的精确度与MGTA-117支持的更有针对性的调节方案相结合,可以进一步改善患有这些严重疾病的患者的治疗效果。当与MGTA-117结合使用时,我们将负责与基础编辑器开发相关的临床试验费用,而Magenta将继续负责MGTA-117的所有其他开发费用。将我们的基础编辑技术的精确度与MGTA-117支持的更有针对性的调节方案相结合,可以进一步改善对这些严重疾病患者的治疗效果。当与MGTA-117结合使用时,我们将负责与基础编辑器开发相关的临床试验费用,而Magenta将继续负责MGTA-117的所有其他开发费用。将我们的基础编辑技术的精确度与MGTA-117支持的更有针对性的调节方案相结合,可以进一步改善对这些严重疾病患者的治疗效果。当与MGTA-117结合使用时,我们将负责与基础编辑器开发相关的临床试验费用,而Magenta将继续负责MGTA-117的所有其他开发费用。
肝病的非病毒输送
神韵疗法
在2019年4月,我们与Verve签订了合作和许可协议,Verve是一家致力于开发遗传药物的公司,可安全编辑成年人的基因组以永久降低LDL胆固醇和甘油三酸酯的水平,从而治疗冠心病。通过这种合作,我们可以充分利用基础编辑在治疗心血管疾病方面的潜力,而在这一核心领域之外,Verve团队拥有大量世界一流的专业知识。根据协议条款,Verve获得了针对某些心血管目标的人类治疗应用的基础编辑技术,基因编辑和传递技术的专有访问权。作为交换,我们获得了2,556,322股Verve普通股。另外,
22
针对这些目标。Verve 根据Verve所控制的专有技术和专利向我们授予了非专有许可,并且对联合协作技术感兴趣。任何一方都可以欠另一方其他里程碑付款,以支付与交付技术产品有关的某些临床和监管事件。根据协议,任何一方都可以根据另一方的任何商品化交付技术产品的净销售额,向另一方支付特许权使用费。
2020年6月,Verve报告了非人类灵长类动物的临床前概念验证数据,证明了成功使用腺嘌呤碱基编辑器关闭了肝脏中的基因。利用从我们获得的ABE技术和包装在工程脂质纳米颗粒中的优化引导RNA,Verve评估了体内肝脏碱基编辑功能,以关闭前蛋白转化酶枯草杆菌蛋白酶/ kexin 9型(PCSK9),该基因的蛋白质产物会升高血液中的LDL胆固醇或血管生成素样蛋白3(ANGPTL3),其蛋白产物可升高血液中富含甘油三酯的脂蛋白的基因。我们认为,这些概念验证数据表明我们可以安全地编辑灵长类动物基因组,代表了基础编辑技术在非人类灵长类动物中的首次成功应用。
在两项单独的研究中,用靶向PCSK9基因的药物治疗了七只动物,而靶向ANGPTL3基因的药物治疗了另外七只动物。在两周时测量全肝编辑,血液蛋白和脂质水平,并与基线进行比较。以PCSK9为目标的程序显示,平均全肝PCSK9编辑率为67%,这意味着血浆PCSK9蛋白降低了89%,血液LDL胆固醇水平降低了59%。针对ANGPTL3的程序显示,平均整个肝脏ANGPTL3的编辑率达到60%,这意味着血浆ANGPTL3蛋白降低了95%,血液甘油三酯水平降低了64%,LDL胆固醇水平降低了19%。此外,在人类原代肝细胞的研究中,
根据我们与Verve达成的协议条款,我们可以在第一阶段研究完成时行使参与任何程序的未来开发和商业化的权利。
眼科和中枢神经系统疾病的病毒输送
IOB
2020年7月,我们宣布了与巴塞尔分子与临床眼科研究所(IOB)的研究合作。IOB由包括诺华,巴塞尔大学医院和巴塞尔大学在内的财团于2018年成立,IOB是基础和转化研究领域的领导者,旨在治疗视力和失明人士。IOB的临床科学家还帮助开发了更好的方法来衡量Stargardt病如何影响视力。此外,IOB的研究人员还开发了视网膜的活体模型,称为类器官,可用于测试新型疗法。根据该协议的条款,两家公司将利用IOB在眼科领域的独特专业知识以及我们新颖的基础编辑技术来推进针对某些眼病的治疗计划,
制造业
为了充分发挥基础编辑器作为一类新型药物的全部潜力,我们正在构建跨发现,制造以及临床前和临床开发的定制和集成功能。由于高质量制造以及控制生产时间和专有技术至关重要,我们已采取步骤建立自己的制造设施,这将使我们能够灵活地制造多种不同的药物产品形式。我们相信这项投资将使我们的产品组合和功能的价值,我们的计划获得技术成功的可能性以及为患者提供终生治愈的速度最大化。
2020年8月,我们与Alexandria Real Estate Equities,Inc.签订了租赁协议,以在北卡罗莱纳州的Research Triangle Park建立一个100,000平方英尺的现行Good Manufacturing Practice或cGMP兼容制造工厂,旨在支持广泛的临床程式。我们将在五年内投资至多8300万美元,并预计该设施将在2023年第一季度投入运营。该项目将部分得到北卡罗莱纳州经济投资委员会批准的JDIG的推动。根据通过该项目产生的新税收来授权潜在的补偿。该设施将旨在支持我们在血液学,肿瘤学和体内的离体细胞治疗计划的制造 肝病的非病毒递送计划,可以灵活地支持我们的病毒递送计划的制定,并最终扩大规模以支持潜在的商业供应。
对于最初的临床计划,我们将使用具有相关基因药物制造经验的合同制造组织或CMO。
新冠肺炎
由于与COVID-19大流行相关的持续关注,我们维持并扩大了业务连续性计划,该计划已在2020年前六个月实施,以解决和减轻COVID-19大流行对我们业务的影响。为了保护员工及其家人和社区的健康,我们于2020年3月限制了必须执行关键活动且必须在现场完成工作的人员进入我们的办公室,这限制了可以在我们公司工作的人员数量随时都可以使用,并要求大多数员工进行远程工作。2020年5月,随着某些州放宽限制,我们建立了新的协议,以更好地允许我们的全部实验室人员访问我们的设施。这些协议包括几个转变
23
每周工作七天的协议。w ^ ê希望继续承担额外费用,以确保我们坚持由疾病控制中心制定的准则,并以我们的现场员工提供一个安全的工作环境。
COVID-19大流行对我们的业务,我们的公司发展目标,经营成果和财务状况(包括我们的普通股的价值和市场)的影响程度将取决于高度不确定且无法预测的未来发展目前充满信心,例如大流行的最终持续时间,旅行限制,隔离,社会疏远和业务关闭要求,以及在全球范围内遏制和治疗该疾病的行动的有效性。全球经济中断,全球医疗体系中断以及COVID-19大流行的其他重大影响可能会对我们的业务,财务状况,运营结果和增长前景产生重大不利影响。
尽管在截至2020年6月30日的六个月中,COVID-19大流行并未对我们的业务或经营成果产生重大影响,但大流行的持续时间和程度,其后果以及遏制措施将决定未来对我们运营和财务的影响健康)状况。
关键会计政策和重大判断
我们的重要会计政策是那些在编制简明综合财务报表时需要作出最重要判断和估计的政策。我们已经确定,最关键的会计政策是与基于股票的薪酬,可变利益主体,公允价值计量和租赁有关的那些会计政策。截至2019年12月31日的年度10-K表年度报告中讨论的我们现有的关键会计政策没有重大变化。
财务业务概览
一般
我们于2017年1月25日注册成立,此后不久开始运营。自成立以来,我们已将全部资源投入到建立基本的编辑平台,促进我们的程序组合的开发,建立和保护我们的知识产权,进行研发活动,为公司组织人员,业务计划,筹集资金。资本,并为这些运营提供一般和行政支持。迄今为止,我们主要通过销售可赎回可转换优先股和IPO收益为运营提供资金。
我们是一家处于开发阶段的公司,我们所有的程序都处于临床前开发阶段。迄今为止,我们尚未从产品销售中获得任何收入,并且预计在可预见的将来不会从产品销售中获得收入。自成立以来,我们已蒙受重大经营亏损。截至2020年6月30日和2019年6月30日止六个月的净亏损分别为6470万美元和3150万美元。截至2020年6月30日,我们的累计亏损额为2.677亿美元。随着我们继续进行候选产品的临床前开发,我们预计与正在进行的与我们的计划组合有关的开发活动将继续产生大量费用,并增加经营亏损;将这些候选产品推进临床开发;进一步开发我们的基础编辑平台;我们寻求发现和开发其他候选产品的研究活动;维护,扩展执法,防御和保护我们的知识产权;以及雇用研发,临床和商业人员。此外,我们预计将继续产生与作为上市公司运营相关的额外费用。
由于这些预期的支出,我们将需要额外的资金来支持我们的持续运营并奉行增长战略。在我们可以从产品销售中获得可观收入之前,我们希望通过股权发行,债务融资,协作,战略联盟和许可安排的组合为我们的运营提供资金。我们可能无法以优惠条件或根本无法筹集额外资金或签订此类其他协议。我们无法按需筹集资金将对我们的财务状况和我们追求业务战略的能力产生负面影响。我们无法保证我们将能够获得这些额外的资金来源来支持我们的运营,或者,如果这些资金可供我们使用,