文章来源:“凯莱英药闻”微信公众号
2021年3月2日,Athenex宣布,FDA对口服紫杉醇和encequidar用于转移性乳腺癌的新药申请(NDA)发出完整回复函(CRL)。这表明申请的审评周期已完成,但该申请目前不具备获批的条件。

在完整回复函中,对于口服紫杉醇组与静脉注射紫杉醇(IVP)组相比,显示出的中性粒细胞减少症相关后遗症增加,对患者构成安全风险,FDA表示担忧。另外,FDA还对第19周由盲性独立中央审查委员会(BICR)进行的客观缓解率(ORR)主要终点结果的不确定性表示担忧。
FDA建议Athenex在以美国人口为代表的转移性乳腺癌患者群体中进行一项新的临床试验,并认为需要采取额外的风险减少策略来降低毒性,这可能需要优化剂量和/或排除被认为具有较高中毒风险的患者,以支持NDA的批准。
口服紫杉醇和encequidar组合疗法开发用于转移性乳腺癌适应症是Athenex临床阶段进展最快的管线,口服版本的紫杉醇也被市场寄予厚望,所以此消息一出,Athenex股价大跌超过50%。
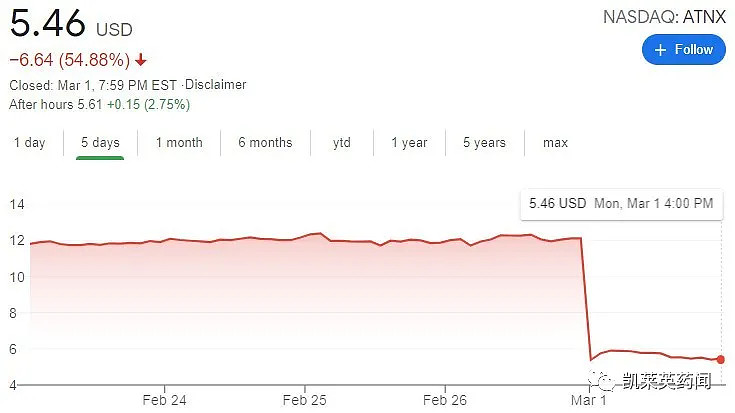
Athenex计划与FDA举行会议以讨论FDA的回复,就临床试验的设计和范围进行对话,以符合FDA的要求,并调整获批所需的后续步骤。
Athenex成立于2003年,设有三个平台,分别为肿瘤创新平台、商业化平台和全球供应链平台。公司现有的临床管线来自四个平台技术:(1)基于p-糖蛋白(P-gp)抑制剂的Orascovery;(2)Src激酶抑制;(3)T细胞受体工程化T细胞(TCR-T);(4)精氨酸消除疗法。
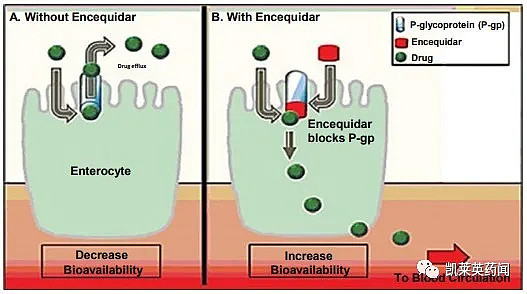
P-gp抑制剂encequiquidar是Orascovery平台的基石。P-gp是胃肠道表面的一种活性转运蛋白,多种抗癌药都是P-gp的底物,口服时会被泵回到胃肠道中,使得药物只能通过静脉给药。作为一种选择性P-gp抑制剂,encequidar使口服紫杉醇、多西紫杉醇、伊立替康、艾瑞布林和拓扑替康等化疗药物成为可能。
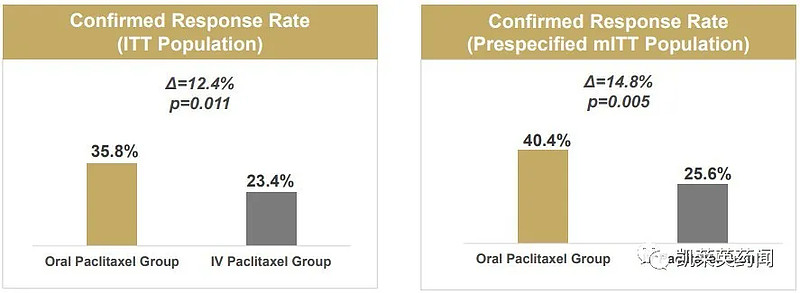
针对转移性乳腺癌的3期临床试验中,与IVP相比,口服紫杉醇和encequidar的组合可显著改善ORR,达到主要终点。
去年9月,FDA受理口服紫杉醇联合encequidar用于治疗转移性乳腺癌的NDA,并授予优先审评资格。
去年12月,Athenex发布了更新的3期临床试验PFS和OS数据,证明口服紫杉醇与IVP相比可使转移性乳腺癌患者在有效性和耐受性方面实现临床获益。这些发现进一步支持了口服紫杉醇ORR提高的优效性。
在改良的意向性治疗(mITT)人群中(n=360),中位PFS数据显示口服紫杉醇相对于IVP获益(分别为8.4和7.4个月;HR=0.739;95% CI:0.561,0.974;p=0.023)。中位OS数据也显示口服紫杉醇优于IVP(分别为23.3个月和16.3个月;HR=0.735;95%CI:0.556,0.972;p=0.026)。
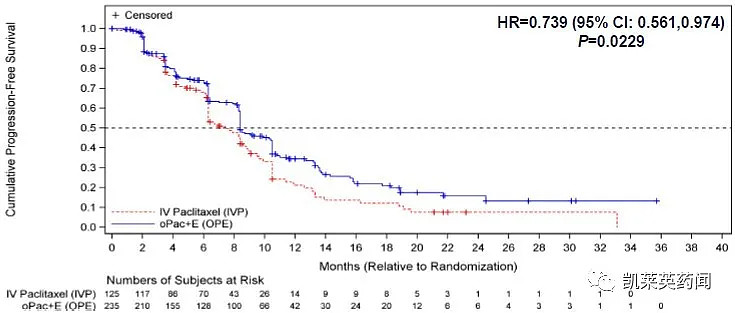
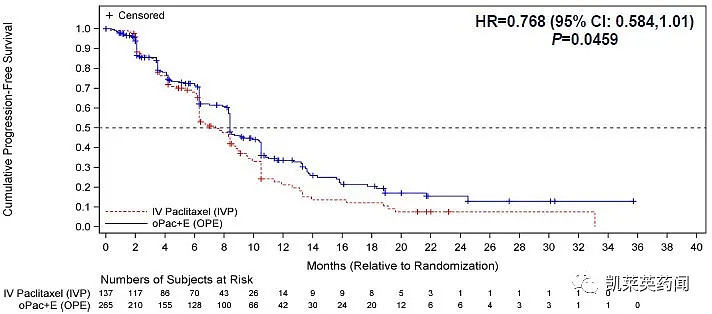
在包括所有402名随机分组患者的意向性治疗(ITT)人群中,中位PFS显示口服紫杉醇相对于IVP获益(分别为8.4个月和7.4个月;HR=0.768;95%CI:0.584,1.01;p=0.046)。中位OS数据显示口服紫杉醇优于IVP的趋势(分别为22.7个月和16.5个月;HR=0.794;95%CI:0.607,1.037;p=0.082)。
长达112周的安全性分析证明,与IVP相比,口服紫杉醇导致神经病变的发生率和严重程度有所降低:所有级别神经病变分别为22%和64%,3级神经病变分别为2%和15%。
如此看来,口服紫杉醇在多个评价指标方面都存在优势,希望Athenex能够尽快找到合适的解决方案,使口服紫杉醇早日上市惠及患者。
版权说明:本文来自凯莱英,感谢关注、转发。欢迎媒体/机构转载,转载请注明来自“凯莱英药闻”。