文章来源:“凯莱英药闻”微信公众号
2021年1月18日,英国药品和保健产品监管局(MHRA)授予Nirsevimab潜力创新药物(PIM)认定。Nirsevimab是一款延长半衰期的单克隆抗体,目前正被研究作为被动免疫用于预防从出生到12个月大的所有婴儿在首个呼吸道合胞病毒(RSV)流行季节由RSV引起的下呼吸道感染(LRTI);以及在第二个RSV流行季节患有慢性肺病或先天性心脏病的24个月内的幼儿。

获得MHRA的PIM认定,必须满足三个条件:(1)疾病危及生命或使人严重衰弱,存在高度未满足需求,即无可用的治疗、诊断或预防方法,或现有方法存在严重局限性;(2)与英国目前使用的方法相比,药品存在显著优势,应提交基于非临床和临床数据的初步证据;(3)获益超过药品潜在不良反应,可以合理预期积极的风险收益平衡。
RSV是一种常见的传染性病毒,可感染呼吸道,是婴幼儿LRTI(例如细支气管炎和肺炎)的主要原因。两岁时,几乎所有幼儿都至少感染过一次RSV。5岁以下儿童中,每年RSV导致全球数百万例住院治疗,以及近60,000例死亡。2015年,全球大约有3300万例急性下呼吸道感染病例,导致超过300万例5岁以下儿童住院治疗。
2017年3月,阿斯利康和赛诺菲巴斯德宣布达成一项合作协议,共同开发和商业化nirsevimab。根据协议条款,阿斯利康将主导所有开发活动直至获批,并参与生产,而赛诺菲巴斯德将负责商业化活动。
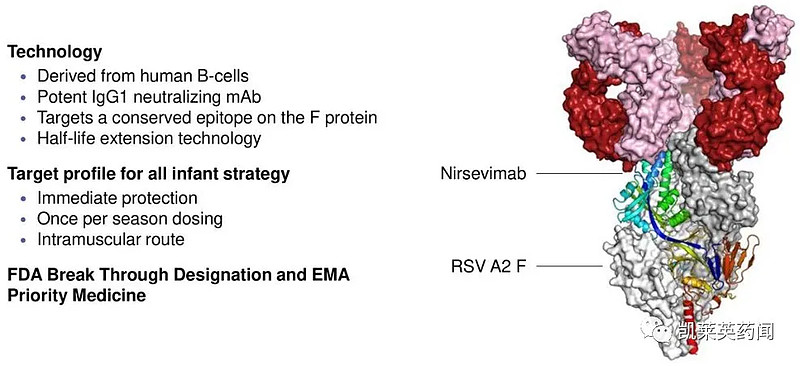
与激活人体免疫系统产生针对病原体的抗体的主动免疫不同,nirsevimab是一种被动免疫,即给婴儿通过肌肉注射(IM)抗体以预防RSV感染,这样能够提供即时的保护。
2019年2月,nirsevimab获得FDA突破性疗法认定,并入选EMA的优先药物(PRIME)计划。2019年7月,赛诺菲和阿斯利康启动关键性3期和2/3期临床试验,以评估nirsevimab预防足月、健康晚期早产和高危婴儿中RSV导致的LRTI的安全性和有效性。
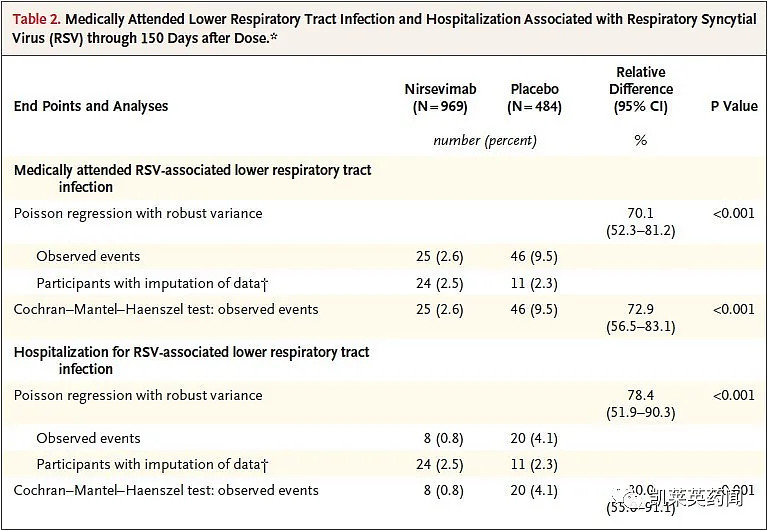
此次的PIM认定是基于nirsevimab的2b期临床试验结果。该项研究中,在RSV流行季节开始时,1453例妊娠29-35周的健康早产婴儿随机分组(2:1),接受单次肌肉注射nirsevimab或安慰剂。数据显示,与安慰剂相比,健康早产儿中RSV导致的LRTI就诊率显著降低(70.1%;[95%CI:52.3%-81.2%])。另外,与安慰剂相比,健康早产婴儿中nirsevimab使RSV引起的LRTI住院治疗率相对降低78.4%(95%CI:51.9%-90.3%)。安全性方面,nirsevimab可耐受,未观察到明显的超敏反应。
版权说明:本文来自凯莱英,感谢关注、转发。欢迎媒体/机构转载,转载请注明来自“凯莱英药闻”。