上周我们主要介绍了第一三共、Synaffix和Mersana等ADC技术平台今天继续一下几家ADC技术:
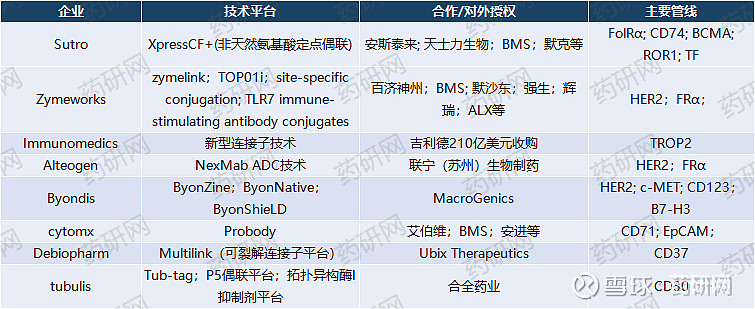
Sutro
Sutro具有工程化突变非天然氨基酸偶联技术——XpressCF+®,允许定制生产、设计和开发含有一个非天然氨基酸的治疗性蛋白质。使用XpressCF+®加入非天然氨基酸,可使蛋白质与一种或多种化学物质以特定位点偶联,实现均一性。
Zymeworks有双抗和ADC两大平台:
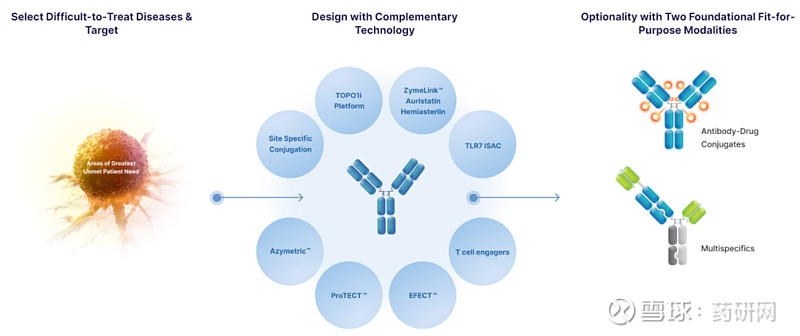
ADC平台:
TOP01 Platform:新型喜树碱类药物作为细胞毒载荷,具有中等效力和较强的旁观者活性,通过半胱氨酸定点偶联,DAR为8;
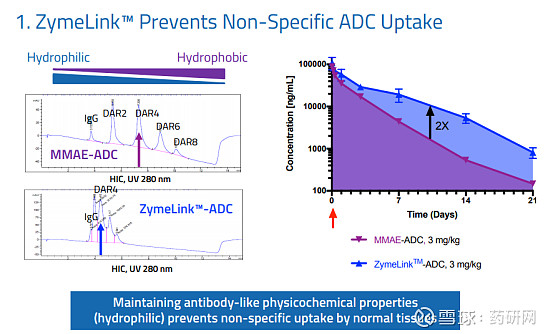
ZymeLink:ZymeLink是Zymeworks早前公布的ADC平台,拥有其专有的细胞毒药物、稳定的连接子和偶联技术。Zymeworks 曾凭借这一技术获得2019年世界ADC奖最佳平台技术奖冠军。
与MMAE-ADC相比,ZymeLink避免非靶向摄取,显著提升ADC稳定性。
ZymeLink的两种载荷是Auristatin和Hemiasterlin。
ZymeLink Auristatin:无旁观者效应,使用无痕可裂解的二肽连接物,高度稳定和亲水,与天然抗体非常相似,可选择半胱氨酸或赖氨酸偶联
ZymeLink Hemiasterlin:有旁观者效应,无痕可裂解的二肽连接子偶联,具有高亲水性,可以实现DAR 8,可选择半胱氨酸或赖氨酸偶联
TLR7 免疫激动剂:抗体通过肽类可裂解连接子与TLR7a偶联。


Immunomedics专有ADC平台的核心是一种新型链接子,该链接子不需要酶来释放有效荷载,可在肿瘤细胞内和肿瘤微环境中递送活性药物,从而产生旁观者效应。
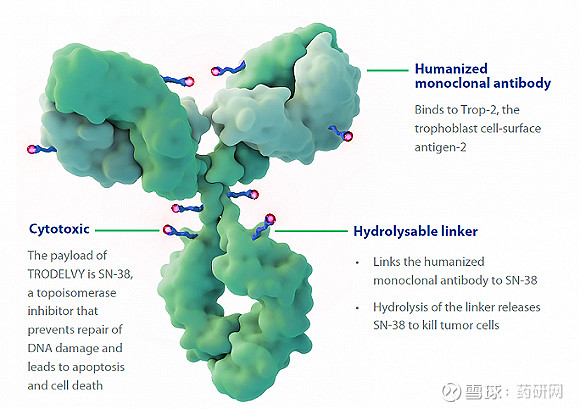
Immunomedics于2020年被吉利德以219亿美元收购,主要资产便是已上市的TROP2 ADC(Trodelvy),治疗三阴性乳腺癌(mTNBC),连接子为CL2A可裂解连接子,包含了九聚乙二醇,可增强ADC的水溶性,DAR高达7.6。
Trodelvy有两种裂解方式:
利用内吞后溶酶体中的cathepsin B裂解赖氨酸部分;
经SN-38的E环中20位羟基的碳酸酯在胞外水解释放出药物从而杀死周边的癌细胞。
Alteogen
Alteogen是一家成立于2008年的韩国生物制药公司,专注于下一代长效Biobetter、ADC药物和抗体生物仿制药。
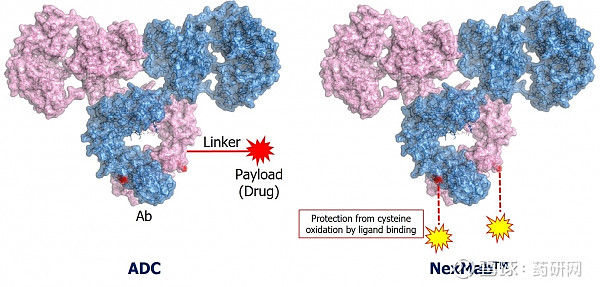
其中ADC药物的开发主要基于其NexMab™技术(多肽酶促偶联技术),在抗体上引入含有半胱氨酸的多肽,通过金属离子保护游离的半胱氨酸,从而选择性偶联不受保护的半胱氨酸,实现定点偶联。在偶联过程中,C 端引入的含有半胱氨酸的肽链可以通过金属离子的配位作用,阻止半胱氨酸偶联。
Byondis
ByonZine:可裂解的DNA破坏性linker-drug,ByonZine ADC可以通过独特的靶向作用和旁观者作用机制有效消除异质性肿瘤,同时杀死正在分裂和未分裂的癌细胞,循环中的游离药物含量极低;
ByonNative:差异化抗体连接平台,通过部分还原的天然二硫键生成ADC,具有去除不需要的非偶联和过度偶联的专有工艺;
ByonShieLD:位点特异性偶联,通过正交半胱氨酸激活和共轭技术生成均一的ADC;
ByonFoLD:双连接子-药物抗体偶联平台,两种不同的有效载荷以兼容的方式与单一抗体偶联,创建具有协同作用的双载荷下一代ADCs;
ByonBranch:分支连接子技术可将有效载荷与抗体连接起来,从而产生疏水性较低的ADCs。
cytomx
cytomx的核心技术是Probody疗法,主要在轻链的N末端再融合表达一个掩蔽肽、一个柔性连接子和一个蛋白酶底物,利用掩蔽肽将抗体的目标结合区域掩盖,无法识别抗原,从而避免其在健康组织中发挥毒性,当抗体在肿瘤组织附近遇到特有的活性蛋白酶时,蛋白酶特异性切割底物,去除掩蔽肽暴露结合位点,从而使抗体特异性结合并杀伤肿瘤细胞。

基于该平台,可开发单抗,双抗,ADC和细胞因子等多种药物,其中cytomx的ADC药物包括其正在开发的CD71 ADC和EpCAM ADC。
Debiopharm
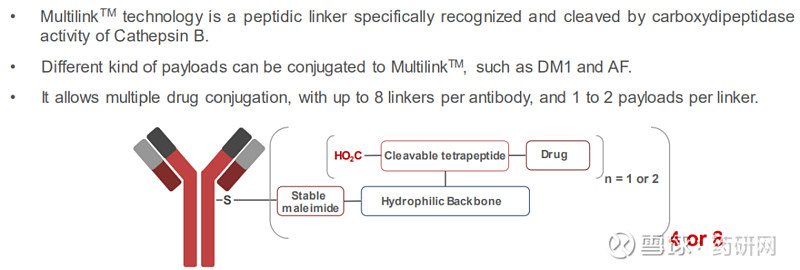
Debiopharm开发了可裂解连接子技术Multilink,该技术可实现快速和特定的裂解,从而导致药物在肿瘤中的有效释放。不同的载荷可以附着在抗体上,DAR可以调节到16。
Tubulis
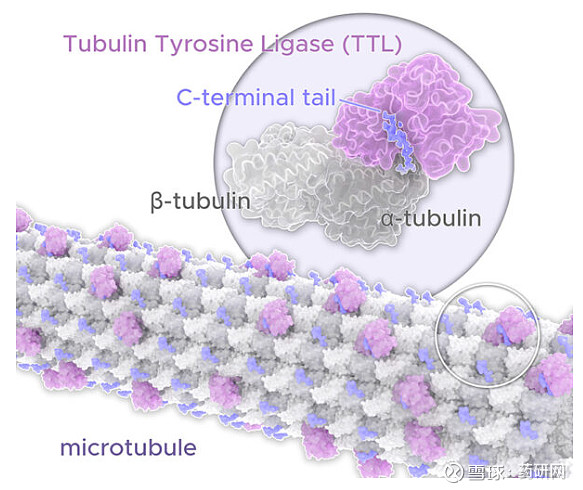
Tub-tag技术:该技术灵感来自微管生物学,通过调节抗体为有效载荷提供有益的微环境,偶联采用的是基于微管蛋白酪氨酸连接酶(TTL)的定点偶联,可生成均一、稳定的ADC。
P5偶联平台:半胱氨酸选择性偶联,可实现DAR为8的均一性,具有绝佳的连接体稳定性和化学柔韧性,能够快速识别先导物。
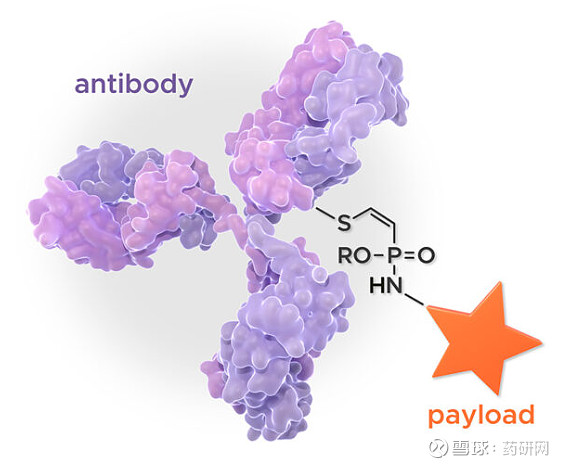
拓扑异构酶I抑制剂平台:tubulis专有的linker-payload平台可提供拓扑异构酶I抑制剂的靶向递送,同时减少不必要的靶向毒性。
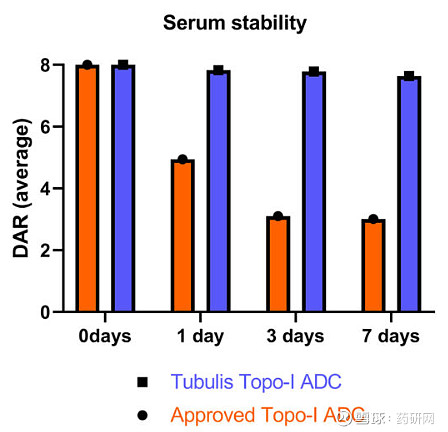
目前已获批的马来酰亚胺为基础的Topo-I ADC,有效载荷会随着时间的推移而减少,三天后的平均DAR仅为3,而基于P5偶联技术的Topo-I ADC药物可在血清中保持稳定的DAR超7天。
上篇参见:国外主要ADC技术梳理(上)
参考:
1. 《基于定点偶联技术的抗体药物偶联物的临床研究进展与挑战》
2. 《Probody®疗法简介及其在ADC中的成功应用》
wechat药研网