天境生物今日宣布,公司和艾伯维已就双方于2020年9月3日签订的原始许可和合作协议达成了一项修正案。
据原始协议,艾伯维向天境生物支付1.8亿美元的预付款和基于第一阶段结果的2000万美元里程碑付款,获得后者CD47抗体lemzoparlimab的独家权益。此外,天境生物将有资格获得高达17.4亿美元的里程碑付款,其中8.4亿美元基于临床开发和监管批准里程碑,其余基于商业里程碑。在lemzoparlimab商业化后,艾伯维还将根据大中华区以外的全球净销售额支付中低比例的分级特许权使用费。
而经修订后的协议显示,双方将继续在抗CD47抗体疗法的全球开发方面进行合作。天境生物将有资格从艾伯维获得12.95亿美元的开发、监管和销售里程碑付款,以及目前正在开发的某些新的抗CD47抗体在大中华区以外的全球净销售额的中到高个位数百分比的分级特许权使用费,或者是先前约定的在2021财年的20-F中披露的其他许可产品(包括基于lemzoparlimab的两款双抗)的原始里程碑付款和分级版税。天境生物拥有在大中华区开发和商业化该协议项下所有许可产品的独家权利。

2021财年20-F部分截图
公告披露,艾伯维将终止lemzoparlimab与阿扎胞苷和venetoclax联合治疗骨髓增生异常综合征(MDS)和急性骨髓细胞性白血病(AML)患者的全球1b期研究。据称这一决定并非基于任何具体或意外的安全问题。
天境方面则将继续致力于lemzoparlimab的开发,近期重点是在中国启动MDS患者的3期临床,该试验主要基于lemzoparlimab和AZA联合治疗高风险MDS患者的2期研究的积极结果,详细数据将在2022年9月举行的欧洲医学肿瘤学会(ESMO)大会上以论文形式展示。
天境生物截至去年年底的现金、现金等价物和短期投资总额约6.71亿美元,可以支撑lemzoparlimab正在进行和计划进行的临床开发项目。
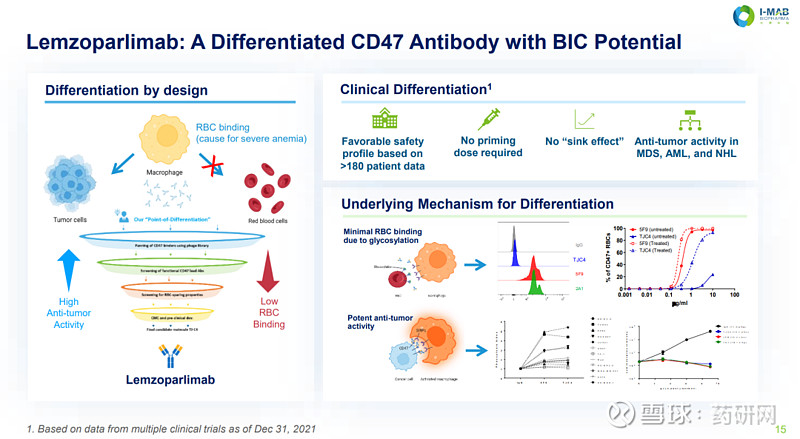
迄今为止,lemzoparlimab在美国和中国的1期和2期临床研究有近200名患者入选,显示出良好的安全性。和Forty Seven/吉利德的Hu5F9-G4不同,lemzoparlimab能够识别独特的CD47抗原表位,而该表位在红细胞上由于糖基化修饰作用使得其不能充分暴露,从而导致lemzoparlimab对红细胞的结合力微弱,这类抗体理论上具有较高的安全性,不需要像Hu5F9-G4那样靠启动剂量(Priming dose)来触发体内老化红细胞的清除(可导致暂时性轻度贫血),刺激网织红细胞成熟分化产生新鲜的年轻红细胞,新生的红细胞表面表达“吃我”信号较低,对CD47抗体介导的吞噬作用不太敏感,以此承受之后的高剂量给药。
此前天境生物已在研发日活动中披露了CD47抗体二期临床的一些进展:
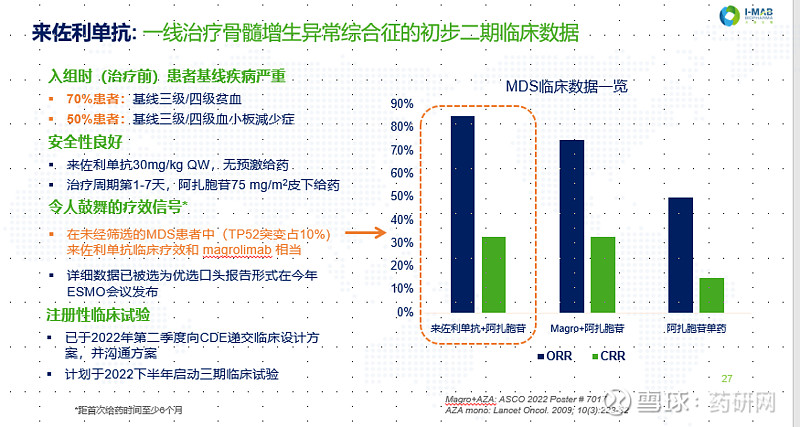
截至2022年6月,已有180多名患者接受了lemzoparlimb治疗,在没有初始剂量方案的情况下,已经取得了良好的安全性。

更多技术梳理见微信自媒体:药研网