最新进展
2022年7月20日,天境生物在研发日活动中披露了CD47抗体的二期临床的最新进展:
图源:医药笔记
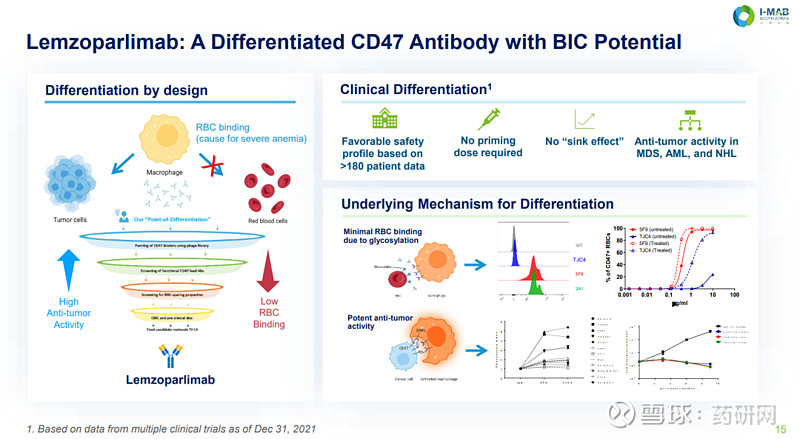
截至2022年6月,已有180多名患者接受了lemzoparlimb治疗,在没有初始剂量方案的情况下,已经取得了良好的安全性。

来源于I-MAB官方披露
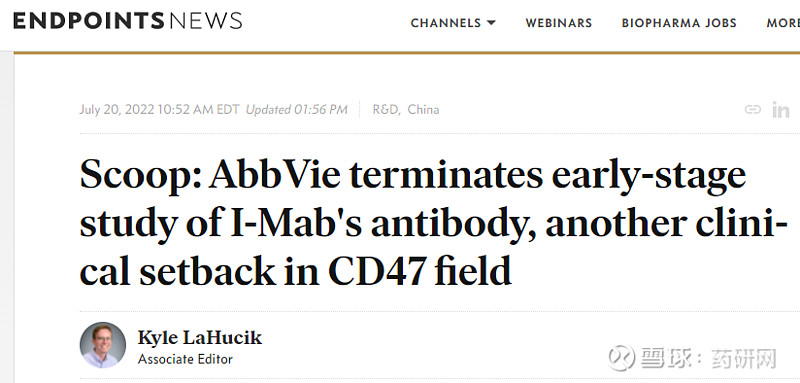
lemzoparlimb在NHL、AML/MDS、实体瘤等多项适应症的临床实验中进展顺利,但据ENDPOINTS NEWS最新报道,艾伯维已经终止了MM一期临床,该一期临床原本计划入组163例,实际上入组8例之后终止。

图源:天境生物
图源:ENDPOINTS NEWS
- 交易回顾 -
2020年3月,吉利德49亿美元收购CD47先驱Forty Seven,获得后者CD47抗体magrolimab;
2020年7月,赛生药业1.2亿美元引进EpicentRx靶向CD47-SIRPα的小分子免疫疗法RRX-001;
2020年9月,天境生物与艾伯维就CD47单抗TJC4达成总价值29亿美元的全球合作;
同月,辉瑞2500万美元投资CD47明星公司Trillium,这家公司在2021年8月底,被辉瑞以22.6亿美元的总价收购…
据海通证券研报显示,CD47药物对于多种血液瘤和实体瘤疗效优异,预计全球市场市场可达225亿美元。CD47已然成为国内肿瘤免疫疗法领域最受关注的靶点之一。
管线格局
全球在研CD47管线逾百条,国内进入临床的至少 17 条,从数量来看和美国旗鼓相当,进度上也没有落后很多。(其他靶点梳理见微信自媒体:药研网)
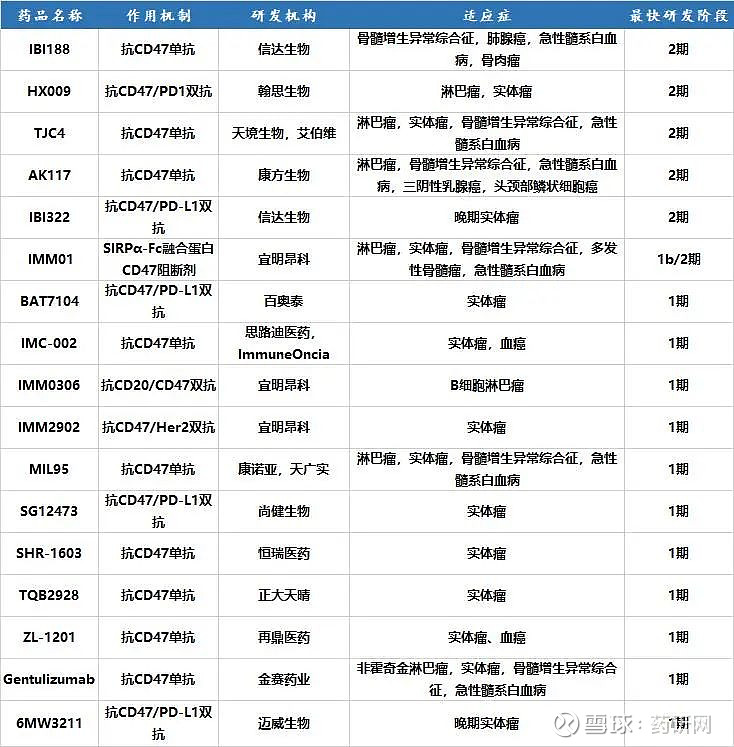
国内单抗双抗都已挺进2期临床,进度较快的是信达生物、翰思生物、天境生物和康方生物。天境生物TJC4有望成为同类最佳,宜明昂科进入临床的管线最多,另外天演药业的条件激活性抗体也值得关注,下面介绍几款。
Magrolimab(Hu5F9-G4)
Forty Seven/吉利德的Hu5F9-G4除了结合肿瘤细胞表面的CD47,也会结合红细胞和血小板表面的CD47。为了降毒选择了没有Fc相关作用的Ig4,本身不具有ADCC/ADCP活性,只是携带阻断CD47-SIRPa的活性,所以单药效果有限。
结构分析揭示了抗CD47抗体Hu5F9-G4的拮抗机制。通过将重、轻可变结构域(VH和VL)与一个短的GGSGG连接体融合,从Hu5F9-G4中制备了一个二抗体。对Hu5F9-G4二抗体/CD47-ECD复合物进行了结晶,晶体结构显示,Hu5F9-G4二抗体形成了一个对称的、域交换的二聚体,连接了2份CD47-ECD。界面以极性接触为主;只有365 Å2和310 Å2的CD47-ECD表面积分别被VH和VL结构域埋藏。Hu5F9-G4的VH通过CDR H1、H2和H3环与CD47-ECD形成6个氢键。Hu5F9-G4的VL与CD47-ECD相互作用,通过CDR L1和L2环形成5个氢键。
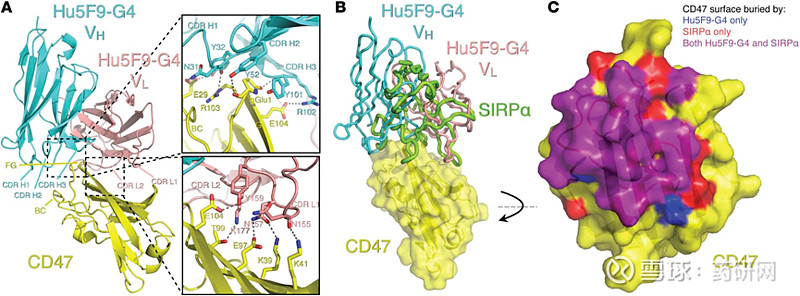
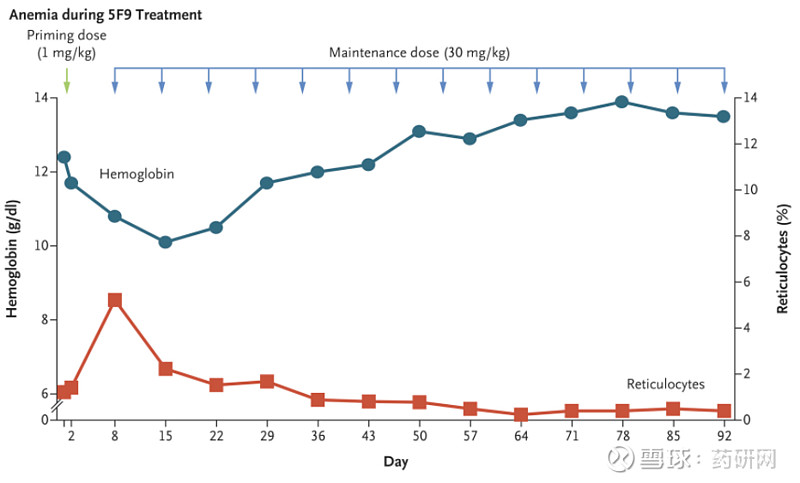
值得一提的是,为了避免因结合红细胞而引起的血液毒性,Hu5F9-G4的给药方案是先给患者1 mg/kg的启动剂量(Priming dose,下图B)来触发体内老化红细胞的清除,虽然会导致暂时性轻度贫血,但同时可以刺激网织红细胞成熟分化产生新鲜的年轻红细胞,这些新生的红细胞表面表达“吃我”信号较低,对CD47抗体介导的吞噬作用不太敏感,因此可以承受之后30 mg/kg的剂量。
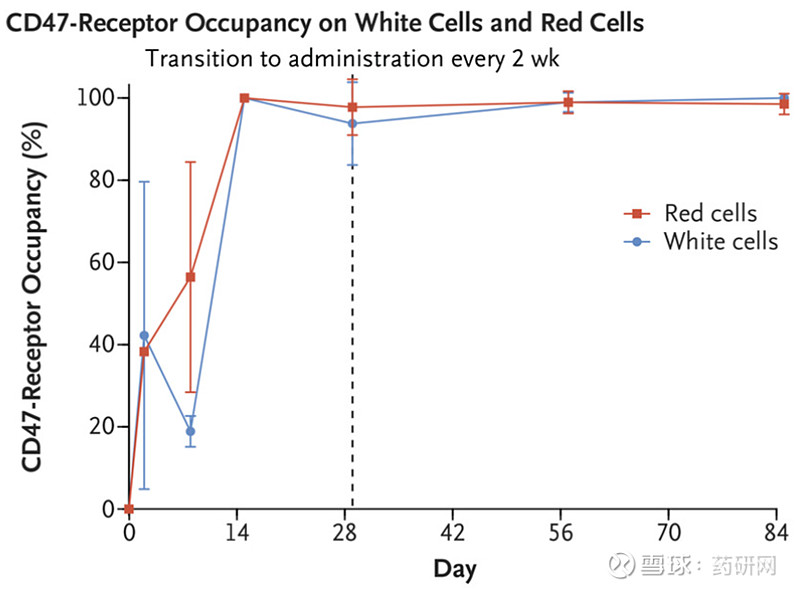
外周白细胞和红细胞上CD47受体的占有率,第29天的虚线显示了从每周接受剂量到每2周接受剂量的过渡。
magrolimab和免疫疗法联用主要是和PD-1/L1、CD20抗体,如与默克Avelumab联用治疗卵巢癌。
magrolimab联合CD20或PD-L1抗体
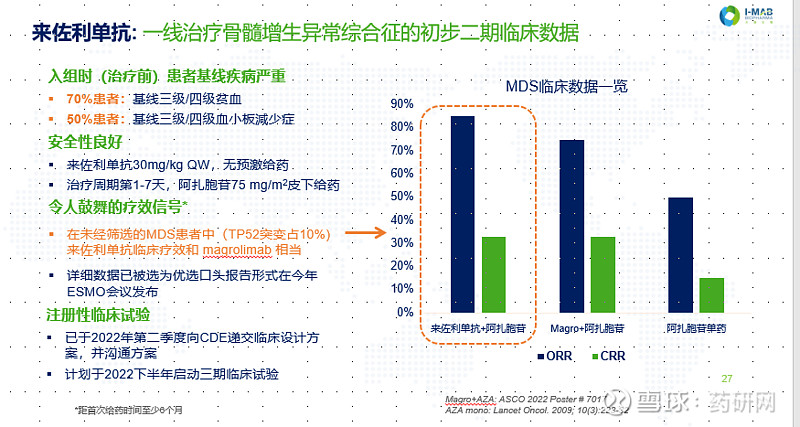
Forty Seven在2019年在ASH会议上公布的Ib期临床实验数据显示Hu5F9-G4在联合阿扎胞苷的情况下对骨髓增生异常综合征(MDS)和急性髓系白血病(AML)患者进行治疗具有良好的效果。
24名MDS患者中,总缓解率(ORR)达到92%,50%(12例)达到完全缓解(CR),33%(8例)达到骨髓形态学CR;22名AML患者中,ORR达64%,41%(9例)达到CR。
2022年1月,该药物因潜在安全性问题被FDA暂停部分临床,在回顾了每个试验的综合安全性数据后,FDA在4月解除了Hu5F9-G4联合阿扎胞苷研究的临床暂停。
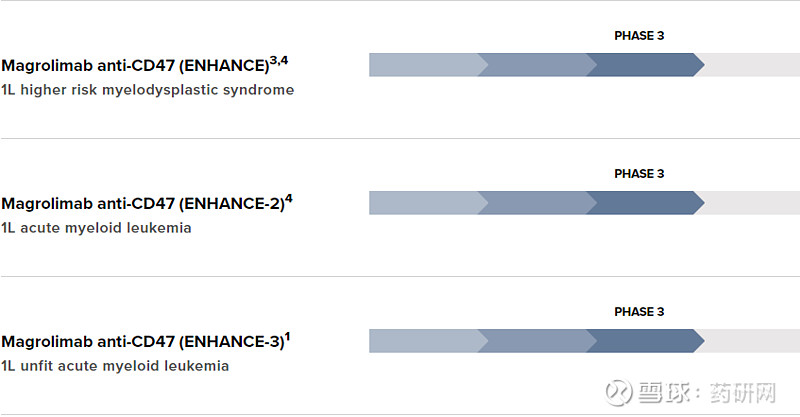
目前这款药的适应症布局和进度:
Lemzoparlimab(TJC4)
和上面Hu5F9-G4不同,天境生物的TJC4能够识别独特的CD47抗原表位,而该表位在红细胞上由于糖基化修饰作用使得其不能充分暴露,从而导致TJC4对红细胞的结合力微弱,这类抗体理论上具有较高的安全性。
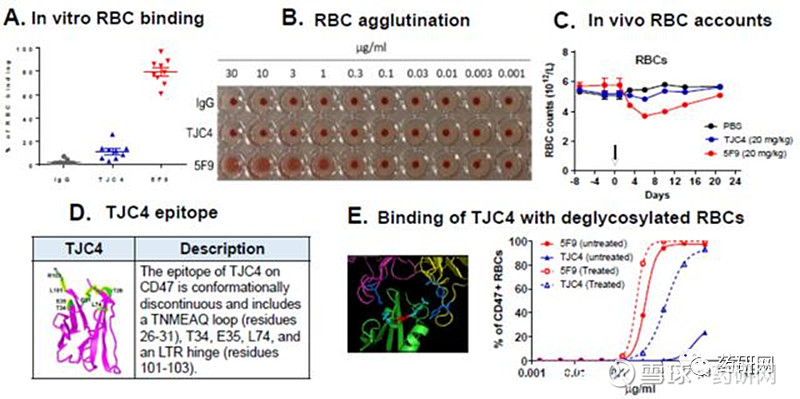
(A)与Forty Seven公司的CD47单抗5F9相比与人红细胞结合更弱。(B) TJC4不会引起凝血。(C)20mg/kg剂量单次注射,TJC4对食蟹猴红细胞计数的影响更小。(D)晶体结构分析TJC4的抗原结合表位。(E)红细胞去糖基化会增加与TJC4的结合。
I/IIa期研究的初步结果表明(NCT04202003),在5名之前接受过2-4次治疗的R/R AML和MDS患者中,具有良好的耐受性安全性和一定的临床疗效。特别值得注意的是,一名原发性难治性AML患者在以1 mg/kg的剂量接受2个周期的lemzoparlimab治疗后,达到形态学无白血病状态( MLFS )。
治疗骨髓异常增生综合征的2期临床进展在文首已介绍。
条件激活性抗体
当抗体进入肿瘤微环境中,在肿瘤中特异性酶的切割下,即可被切割暴露结合表位并激活其结合活性。如天演药业的ADG153 SAFEbody。
SAFEbody由遮蔽肽、可以被酶降解的Linker和可以结合肿瘤抗原的抗体组成,主要元件是遮蔽肽和可以降解的linker。据其专利描述,该linker可以被肿瘤微环境中特异性酶切割降解,从而将遮蔽肽从抗体上释放出来,进而暴漏抗体的抗原结合位点。在正常组织中,该linker无法被降解,因此抗体无法与正常组织上的抗原结合。
ADG153具有IgG1介导的强大效应器功能,可有效杀伤肿瘤,同时最大限度地减少抗原沉降和红细胞(RBC)耗竭。
头对头体外研究比较Hu5F9和未被掩蔽的IgG4同型的ADG153抗体的活性。结果这两种抗体都阻断了人类SIRPα与人类CD47的结合;与人类CD47蛋白、CD47阳性肿瘤细胞系和人类红细胞结合的效力相似;以及诱导了巨噬细胞的吞噬。
相比之下,ADG153 SAFEbody在同样的体外试验中表现出明显的活性降低(>450倍),显示出强烈的掩盖效率。与Hu5F9不同,ADG153母体和SAFEbody分子都不会引起体外人类红细胞的血凝。
尽管ADG153 SAFEbody在体外与CD47的结合明显减少,但它在体内小鼠肿瘤模型中表现出强大的抗肿瘤活性。在扩散性和皮下CD47阳性的Raji肿瘤模型中,IgG4同型的ADG153 SAFEbody显示出与Hu5F9相似的抗肿瘤活性。
安全性上,在犬猴的探索性毒理学研究中,ADG153 SAFEbody在红细胞、血红蛋白和血细胞比值方面的降幅明显低于Hu5F9。Hu5F9在10mg/kg时引起RBCs最大下降49%,而ADG153 SAFEbody是8%,在这个剂量耐受性良好。(下图A)。
与Hu5F9相比,猴子单次静脉注射ADG153 SAFEbody的药代动力学(PK)研究表明,10mg/kg时,表观半衰期延长8倍,方便剂量和给药。
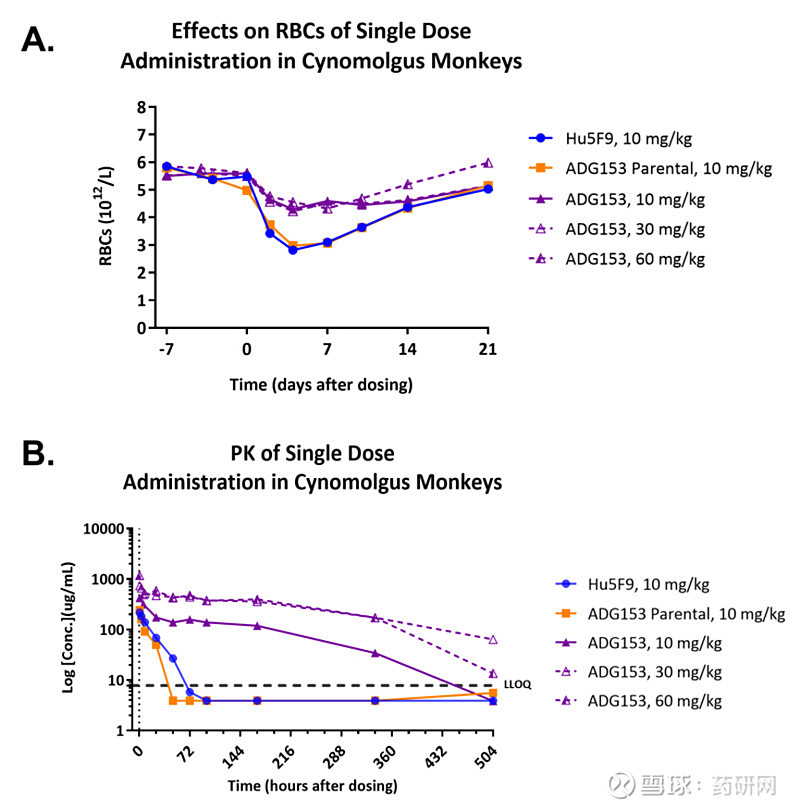
天演药业在2021年ASH会议上披露了上述信息,目前这款药还没进入临床。
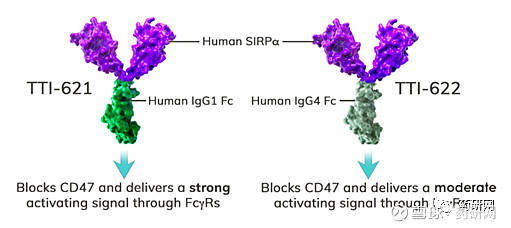
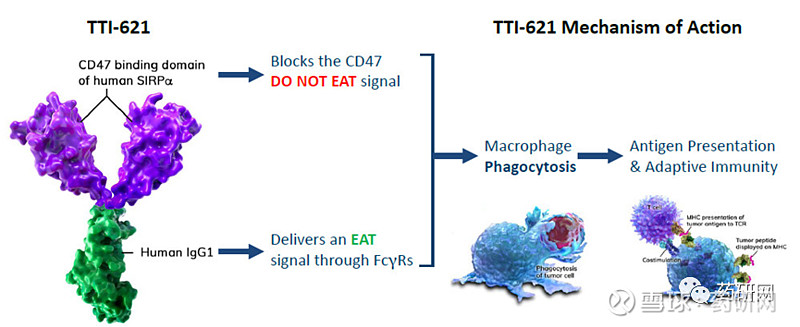
TTI-621、TTI-622
Trillium的这两款候选药均为靶向CD47的SIRPα融合蛋白。这类疗法的特点在于只结合肿瘤细胞的CD47而非红细胞表面的CD47,从而可降低患者贫血风险。
Trillium阻断CD47的方法是使用诱饵受体(SIRPαFc)。两款药物的不同在于Fc亚型不同,TTI-621和TTI-622分别采用IgG1 Fc和IgG4 Fc,由于TTI-622的IgG4 Fc区与Fc受体的相互作用比IgG1更为有限,因此推测TTI-622会向巨噬细胞传递更适度的“吞噬”信号。
2020年ASCO大会上,Trillium公布TTI-622用于治疗复发难治性淋巴瘤的Ⅰ期临床数据:已经观察到1例部分缓解、1例完全缓解。此前,TTI-621单药治疗已经观察到完全缓。
AO-176
Arch Oncology的AO-176主要用于实体瘤患者的治疗,其同样也是结合肿瘤细胞而不结合红细胞。
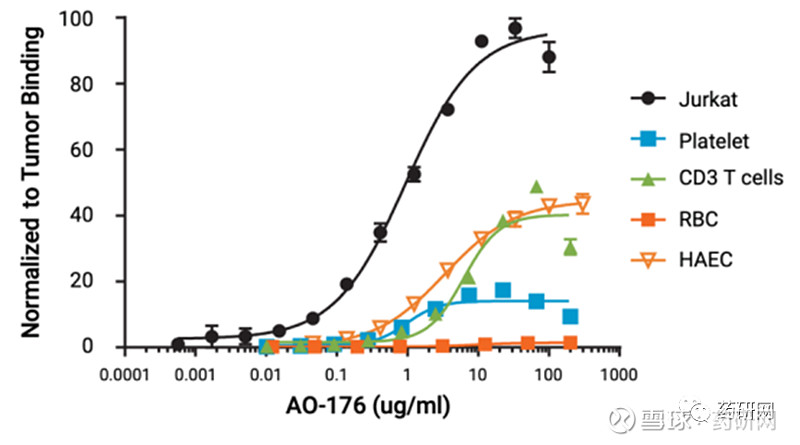
AO-176和不同细胞的结合
AO-176采用IgG2型,具有高度差异化特征,有潜力提高其安全性和有效性。具体来说,该疗法不仅能优先与肿瘤细胞而非正常细胞结合,在其酸性微环境(低pH)中更有效地结合肿瘤,而且其还可直接杀死肿瘤细胞。
ALX148
ALX148是由ALX Oncology开发的SIRPα V1D1-Fc融合蛋白,该蛋白对SIRPαV1D1进行突变(V6I, A271,I31F, E47V, K53R, E54S, H56P, L66T, V92I),改造后的SIRPαV1D1与野生型相比对CD47的亲合力提高了50000倍,同时该药物采用突变消除Fc的相关效应功能,进一步提高安全性。因此,虽然ALX148可以结合红细胞表面的CD47,但是其不会对红细胞造成损伤。
另外该药物本身药效有限,临床中主要和其它药物联用。
ALX148的分子量是抗体的一半,能够以大约抗CD47抗体一半的剂量实现线性药代动力学,并达到CD47靶点的占有率。
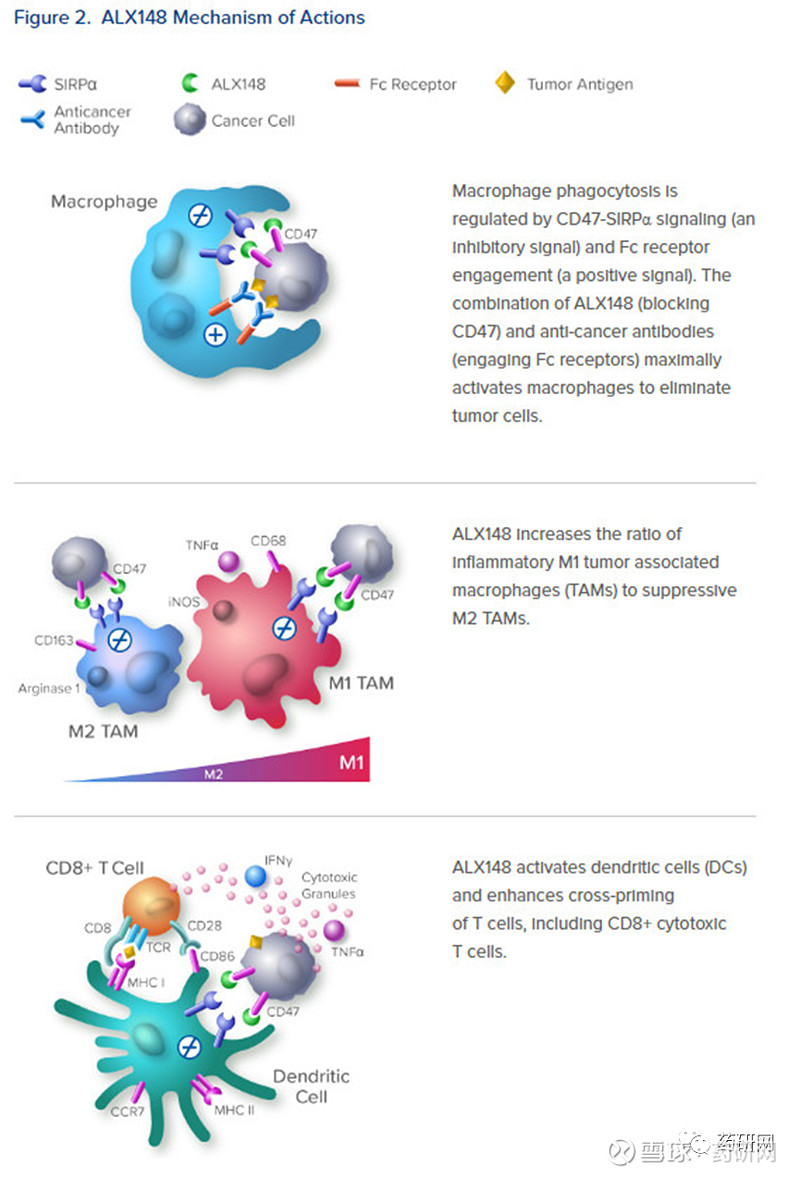
最近的临床数据表明,将ALX148与曲妥珠单抗、ramucirumab和紫杉醇的标准给药方案联合使用,初步证实的有希望的客观缓解率为72%,估计12个月的OS为76%。没有达到最大耐受剂量。
IBI188、IBI322
信达生物在CD47单抗Letaplimab(IBI188)率先进入2期临床的前提下,继续加大对IBI322(CD47/PD-L1)的研发投入,目前也已进入2期临床。此外,2020年3月又引入美国生物制药公司Alector的AL0008。
IBI188是一款重组全人源抗CD47单克隆抗体,拟用于治疗包括非霍奇金淋巴瘤、卵巢癌在内的多种血液肿瘤和实体肿瘤。体内外实验均显示,IBI188能够结合肿瘤细胞表面的CD47抗原,阻断CD47-SIRPα信号通路,抑制CD47传递的“别吃我”信号,从而使巨噬细胞识别肿瘤细胞,发挥机体的抗肿瘤效应。
信达生物在SITC2020上公布了IBI188的1a期临床的研究成果。研究入组20例受试者设置7个剂量组,从0.1mg/kg至30mg/kg每周给药1次。安全性数据显示了其CD47单抗整体耐受性良好,单药使用后整体贫血发生率为15%,3例3/4级不良反应。
IBI-188在Raji淋巴瘤模型中的药效要优于Hu5F9-G4,NHPs研究耐受性良好。
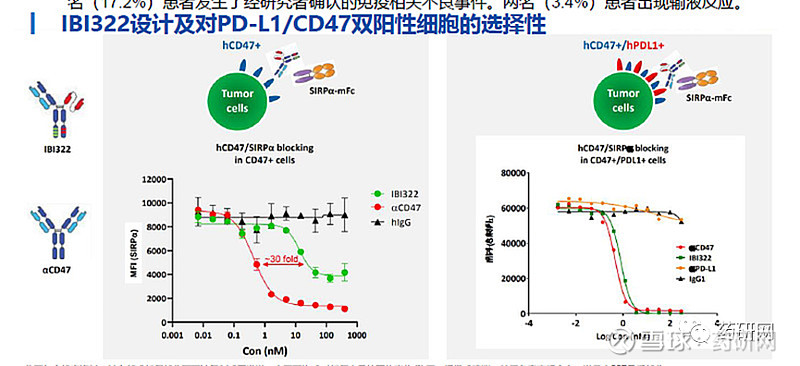
IBI-322则是一种可同时靶向CD47和PD-L1的新型双特异性抗体,可同时阻断PD-1/PD-L1和CD47/SIRP-α通路。其主要是通过抗体的结合价数调节对两个靶点的结合能力,该双抗采用1+2的形式,其中一个结合位点靶向CD47,另外两个结合位点靶向PD-L1,从而增加抗体在肿瘤中的分配,最终达到增加安全性的目的。

2022年AACR年会上,信达公布了IBI322单药用于治疗晚期实体瘤患者的的first-in-human临床I期研究早期剂量递增/扩展部分的结果。
该临床I期试验招募了18-75岁,ECOG PS 0-1的患有局部晚期、复发性或转移性实体瘤患者。剂量递增部分采用加速滴定和标准3+3设计,静脉注射0.01-45 mg/kg,每周一次、两次或三次。剂量扩展部分采取10-30 mg/kg,每周2-3次的给药剂量。截至2021年10月12日,共招募了58名患者,年龄53±11.7岁,其中37名男性(63.8%),ECOG PS 1的患者38名(65.5%),曾接受过ICI治疗的患者15名(25.9%)。
疗效结果:在接受有效剂量(≥10 mg/kg)治疗并至少进行一次肿瘤评估的20名患者中,4名(20%)达到PR,7名(35%)达到SD。在接受有效剂量(≥10 mg/kg)治疗的9名NSCLC患者(包括4名先前ICI治疗失败的患者)中,3名(33.3%)达到PR,5名(55.6%)达到SD。截至数据截止日期,以上4名达到PR的患者仍继续接受IBI322单药治疗。
安全性结果:仅有一例4级可逆性血小板减少症DLT发生在20 mg/kg Q2W组。43名(74.1%)患者发生了各级别的TRAE。最常见的TRAE包括贫血(31.0%)、血小板减少(22.4%)和发热(15.5%)。13名(22.4%)患者发生≥3级TRAE,最常见的≥3级TRAE为血小板减少症(12.1%)。所有血小板减少症均无症状、短暂且在10天内可恢复,没有导致出血。10名(17.2%)患者发生了经研究者确认的免疫相关不良事件。两名(3.4%)患者出现输液反应
SRF231
该药物是Surface Oncology开发的一款全人IgG4抗CD47抗体,此前FDA已授予其孤儿药资格,用于治疗多发性骨髓瘤患者。
SRF231通过吞噬和细胞死亡在体外发挥抗肿瘤活性。依赖于激活Fcγ受体(FcγR)CD32a,SRF231与巨噬细胞源性CD32a的结合具有双重作用:诱导FcγR介导的癌细胞吞噬,并作为支架将CD47介导的死亡信号导入肿瘤细胞。
SRF231一个潜在安全优势在于,其不会引起可检测到的红细胞凝集或吞噬。临床前研究表明,无论单一药物或是与利妥昔单抗等联合使用,SRF231都能与CD47高亲和力结合,在体外促进吞噬作用并杀死癌细胞,具有强大的抗肿瘤活性。
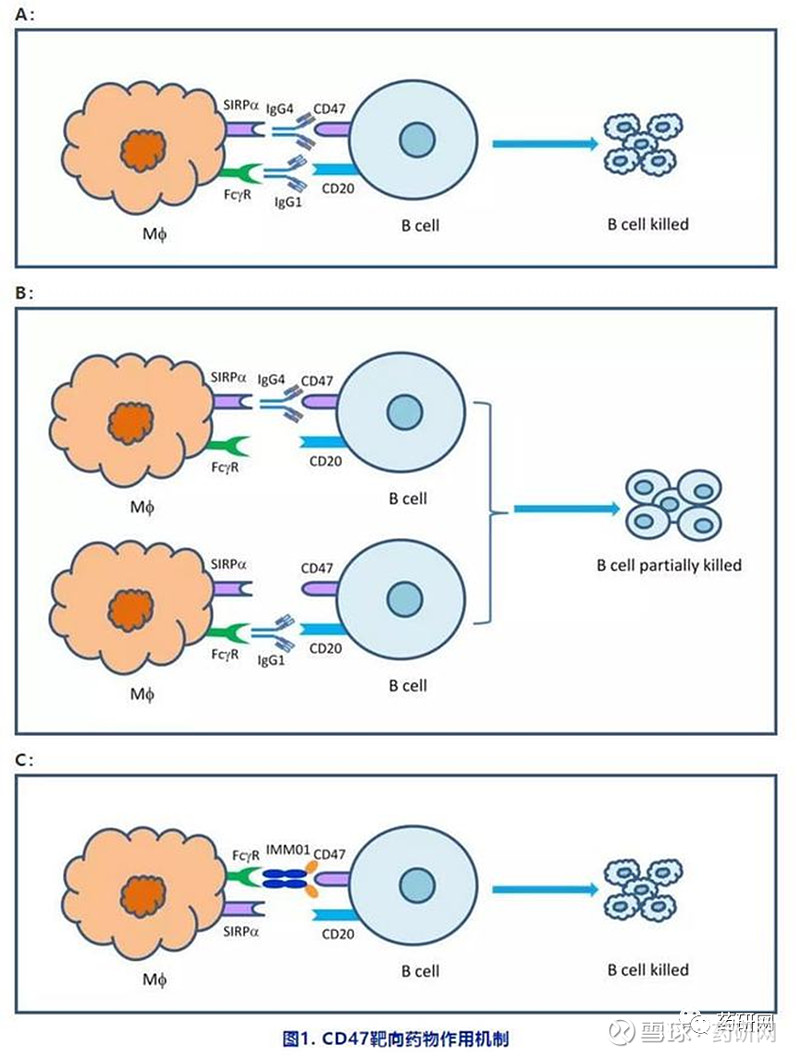
IMM01、 IMM0306
IMM01是宜明昂科基于其“mAb-Trap”技术平台而开发的新一代免疫检查点抑制剂,主要作用机理是在阻断CD47靶点同时引发强效ADCP,通过激活巨噬细胞对肿瘤细胞的吞噬作用,并将吞噬处理的肿瘤抗原递呈给T细胞,从而发挥强大的肿瘤免疫治疗效应,同时完全不与人红细胞结合。临床前研究数据证实,IMM01在多种肿瘤模型中均取得显著的治疗效果。
目前,有1项正在进行的临床试验( CTR20191531 )。初步结果显示,一些患者出现了前所未有的反应,尤其是R/R经典霍奇金淋巴瘤( cHL )患者。在五名cHL登记受试者中,一名PD-1耐药疾病患者在57周内达到PR并继续接受治疗,3名患者达到SD,总体疾病控制率为80%。
IMM01不与人类红细胞结合,在去糖基化修饰后,IMM01的免疫原性降低。因此,IMM01具有良好的PK、更好的组织通透性和生物利用度,以及更好的安全性,这反映在迄今为止招募的受试者中没有抗药物抗体( ADA )以及与药物相关的严重不良事件( SAE )。
IMM0306则是一种同时靶向CD47和CD20的双特异性抗体,其不仅可发挥强大的肿瘤免疫治疗效应,还可以通过和肿瘤细胞表面的CD20结合而避开与正常组织CD47的结合,从而减低CD47靶点相关毒性。
图源:宜明昂科官网
AK117(Ligufalimab)
康方生物AK117是一种具有独特结构的抗CD47单克隆抗体,采用Ig4亚型并通过工程化最大限度降低Fc效应,并具有良好的血液学安全性和强大的促吞噬活性。
在体外实验中,AK117区别于其他抗CD47抗体药物的差异化特征:食蟹猴贫血发生的影响很小,仅出现轻微的红细胞变化;对人血红细胞以及血小板的结合能力弱,不引起血小板毒性,同时不引起不引起红细胞聚集。
一期临床试验( NCT04349969 )对15例晚期或转移性实体瘤患者进行的初步研究表明,AK117是安全的,耐受性良好,未观察到与输注相关的反应( IRR )或严重治疗相关的不良事件( TRAE )。
截至2021年8月30日,正在进行4项临床试验( NDS04900350,NCT0498088,NCT0478334和NCT0434999 )。同时,国内有3项正在进行的临床试验( CTR2011305、CTR2010825、CTR20202684 )
双抗
CD47的双抗思路在辉瑞、信达的探索下逐渐成熟,双抗将结合CD47或者SIRPα的结构域的亲合力降低(低于另外一个靶点的亲合力),从而使得抗体在目标细胞上聚集,减少抗体对红细胞等细胞的结合,从而增加安全性,提高治疗窗口。

辉瑞PF-07257876作用机制
参考:1.网页链接;2.网页链接;3. 网页链接;4.网页链接;5.PLoS One. 2015 Sep 21;10(9):e0137345;6.Immunology 2014;143:61-7. 10.1111/imm.12290;7.Exp Hematol. 2014 Mar;42(3):163-171.e1;8.相关企业官网;9.相关企业SEC文件.