
导读:6月14日,浙江华海药业发布公告称该公司盐酸二甲双胍缓释片获得美国FDA批准文号,根据FDA官网信息,截至目前华海药业共有71个ANDA/205品规药品获FDA批准。详情见下。

截图来源:华海药业企业公告
公告全文简述:
获批药品基本情况
药物名称:盐酸二甲双胍缓释片
ANDA 号:212681
剂型:片剂
规格:500mg、1000mg
申请事项:ANDA(美国新药简略申请)
申请人:普霖斯通制药有限公司(Prinston Pharmaceutical, Inc.)
盐酸二甲双胍缓释片是一种降糖药,具有提高二型糖尿病患者的血糖受耐性,降低基础和餐后血糖的作用。该药品由 Bausch Health US, LLC (Bausch).公司研发,于 2005 年在美国批准上市。当前,美国境内生产厂商主要有 Granuals Glenmark、 Lupin 等。
据药融云统计,盐酸二甲双胍缓释片在我国院内前几年的销售一直呈持续上升趋势,最高达到7.27亿元。但2021年的销售额不太乐观,下滑约3.6亿元,同比下降49.65%。
盐酸二甲双胍缓释片院内销售情况
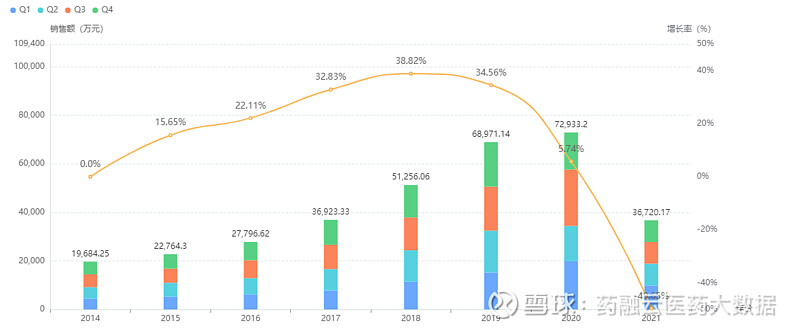
截图来源:药融云全国医院销售数据库(新版)
此外,截至目前,华海药业在盐酸二甲双胍缓释片美国研发项目上已投入研发费用约 870 万元人民币。
华海药业还在公告中指出:本次盐酸二甲双胍缓释片 ANDA 文号的获批标志着公司具备了在美国市场销售 该产品的资格,有利于公司不断扩大美国市场销售,强化产品供应链,丰富产品梯队,提升公司产品的市场竞争力,对公司的经营业绩产生积极的影响。
根据FDA官网信息,华海药业美国子公司普霖斯通制药有限公司(Prinston Pharmaceutical, Inc.) 已经在FDA获批71个ANDA申请号、涵盖205品规药品。(包括9品规停产撤市产品)。
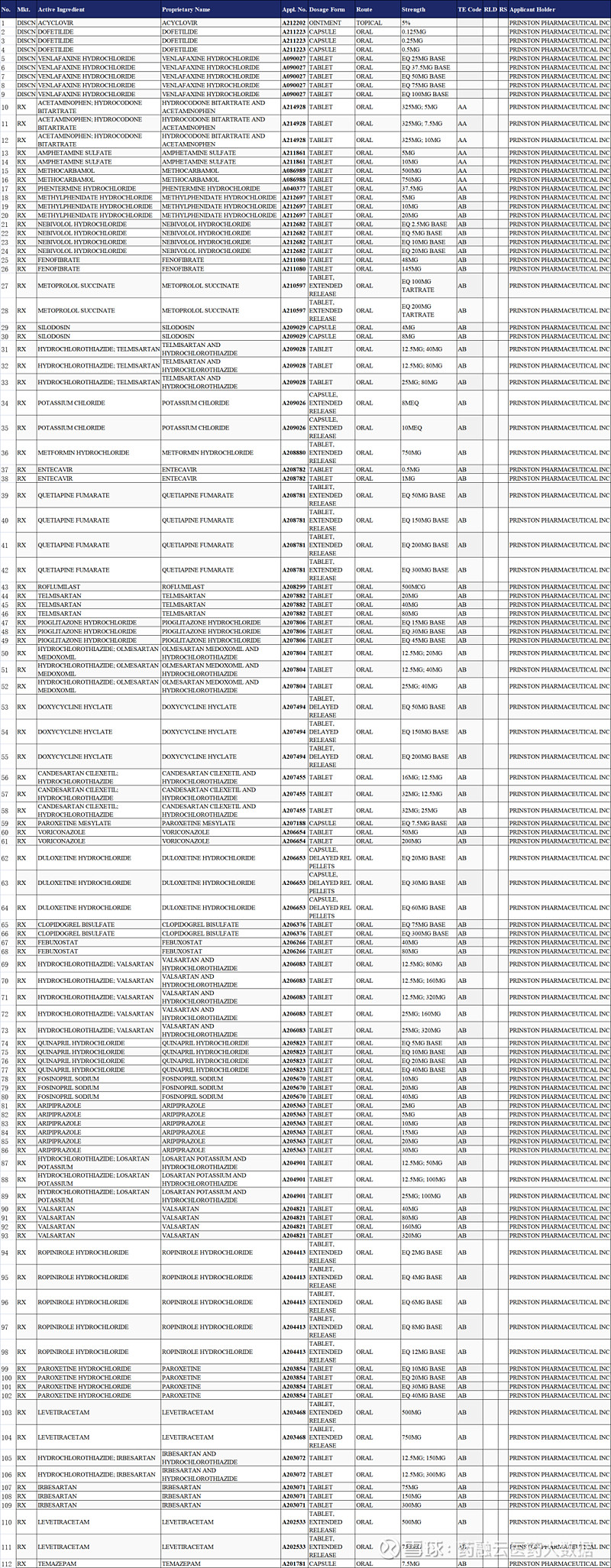
截图来源:FDA官网
公告原文见下:

截图来源:华海药业企业公告
参考来源:
[1] 华海药业企业公告
[2] 药融云数据库
[3] FDA官网
$华海药业(SH600521)$ $Bausch Health(BHC)$ #华海药业# #二甲双胍# #美国FDA#
想要解锁更多药企仿制药信息吗?查询药融云数据库(网页链接)掌握药企仿制药申报情况、审批信息、最新进展、一致性评价、市场竞争格局、销售情况,市场规模与前景,可否投入!注册立享15天免费试用和虎年首份医药数据大礼包!
<END>