
刚刚过去的5月份对于Amgen来说,绝对是一个幸运月。
5月28日,FDA批准Bkemv用于两种罕见病。这是作为原研产品Soliris(依库珠单抗)的可互换生物类似药。
稍早之前5月16日,FDA加速批准塔拉妥单抗(tarlatamab-dlle,Imdelltra)用于治疗在铂类化疗期间或之后疾病进展的广泛期小细胞肺癌。

这是全球首个也是目前唯一一款获批用于主要实体瘤的双特异性T Cell Engager疗法(DLL3/CD3)。约85%-96%的SCLC患者表达DLL3,也就成为治疗SCLC非常理想的靶点,患者在用药前也无须检测DLL3水平。

作为一款DLL3/CD3双特异性抗体,tarlatamab进入体内后靶向DLL3抗原,同时通过CD3抗原结合患者自身T细胞。随后在T细胞和DLL3表达细胞之间形成突触,触发T细胞激活,从而引发炎症细胞因子释放以及DLL3表达细胞溶解,由此达到激活患者自身T细胞去攻击表达DLL3的癌细胞的作用过程。这款产品也是首个具有高度选择性作用机制的SCLC治疗药物。

在一项2期临床试验中(DeLLphi-301 p),总体应答率达到40%,中位持续应答时间9.7个月,中位总体生存期14.3个月。基于此,FDA做出了加速批准的决定,同时也给Amgen留下了诸多作业,进一步完善tarlatamab的疗效、安全性和CMC。
首当其冲的当然是开展3期临床试验。FDA要求Amgen开展一项多中心随机临床试验,确认tarlatamab在广泛期小细胞肺癌患者中的临床获益,毕竟之前的2期临床试验只是小范围的初步数据,离完全批准是远远不够的。
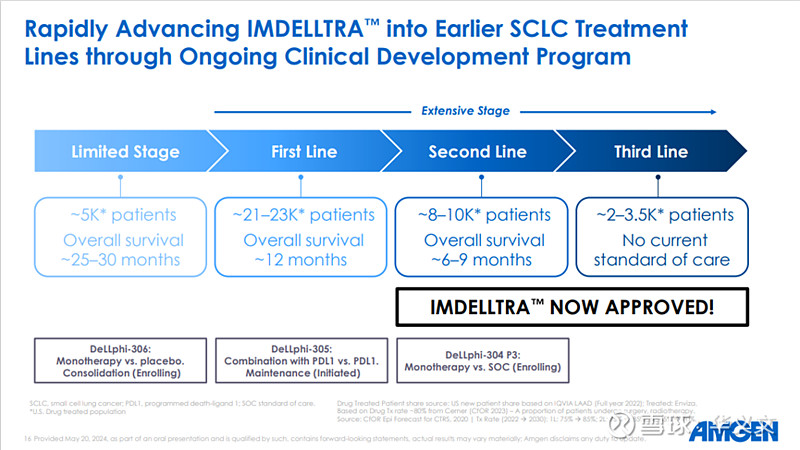
对此,Amgen是早有行动。在5月6日,也就是批准前几天提交的时间表来看,3期临床试验(Dellphi-304)的最终方案早在2022年12月就已经提交,目前这项试验在进行中,预计在2026年4月结束,并在2026年8月提交最终临床报告。
此次加速批准只是2线治疗,Amgen显然是不满足于此的。Amgen已经启动新的临床试验,目的就是冲击一线疗法,包括Dellphi-305是联合PD-L1疗法的维持治疗,以及Dellphi-306是单用巩固治疗局限期SCLC。如果这两项临床试验成功,就可以将SCLC全部拿下。
其次,FDA认为Amgen计划提交一份上市后自发不良事件分析报告是不足以评估细胞因子释放综合征(CRS)、免疫效应细胞相关神经毒性综合征(ICANS)以及神经毒性的严重风险,因此Amgen必须开展一项全面安全性分析,以确定长期发生率、严重性和结果。最终报告的递交时间是2026年8月。
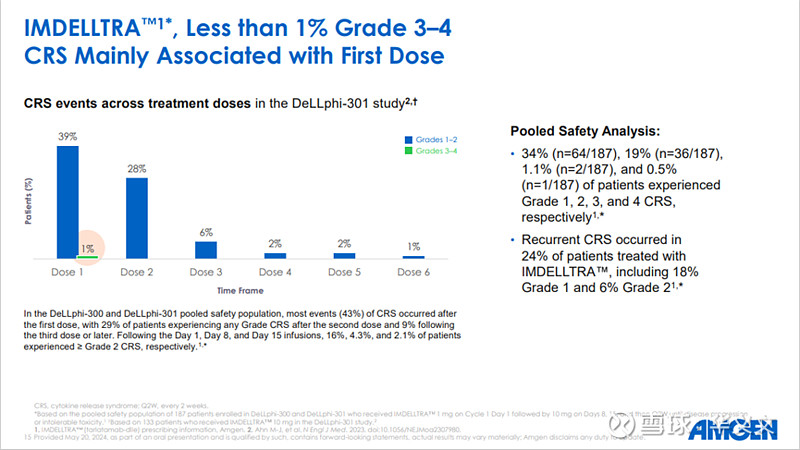
鉴于此次加速审批说明书中将CRS和ICANS列入黑框警告,FDA要求Amgen加强药物警戒监测,特别是在首次批准后3年内按15天上报全部CRS和ICANS案例。

此外,Amgen还应当收集美国代表性少数族裔SCLC患者数据并开展综合分析。最终报告提交日期是2027年4月。
除了上述疗效和安全性的要求之外,FDA也提出了一项CMC要求,其实也是和安全性有关。FDA要求Amgen开发单核细胞活化反应测定法(monocyte activation test)能够可靠测定静脉输液稳定剂(IV Solution Stabilizer)中的内毒素。方法开发可行性研究结果需要在2025年1月前提交。如果方法可行性研究通过,接下来就需要开展有三批IVSS的方法验证研究,并在2026年1月前提交方法验证报告。如果MAT方法证明不可行,那么Amgen承诺开发一种内毒素检测的替代方法,该方法不受内毒素低回收率的影响。
所谓IVSS,就是一种无菌、无防腐剂、无色至淡黄色澄清溶液。每瓶IVSS含一水柠檬酸(36.75 mg)、盐酸赖氨酸(1598.8 mg)、聚山梨酯80(7 mg)、氢氧化钠调节pH到7.0,以及注射用水。IVSS的用途是在往输液袋中加入tarlatamab之前,先用IVSS润洗输液袋内部以免tarlatamab吸附到输液袋和输液管内壁。