
$华润三九(SZ000999)$ #CDMO# #抗生素# $ST长康(SZ002435)$
【华义文随笔】
今天,CDE网站拟优先审评品种公示更新了一条信息:华润九新的注射用头孢比罗酯钠。在拟优先审评的理由中提到了《国家药监局关于优化已在境内上市的境外生产药品转移至境内生产的药品上市注册申请相关事项的公告》(2024年第49号)。
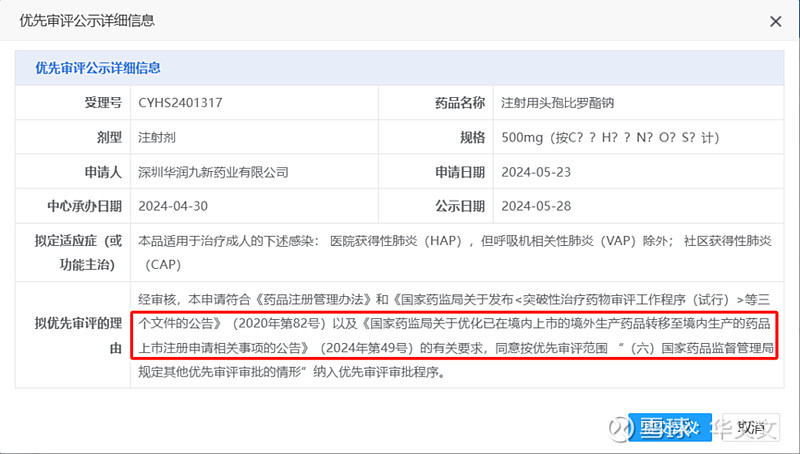
从时间点可以看出来,华润九新一直在关注这项新政。
虽然49号文的落款日期是4月19日,但是在国家局网站公布的时间是在4月23日。而华润九新提交的国产上市申请是在4月30日被CDE承办的,按照一般受理时间5个工作日推算,恰好就在新政挂网时候。
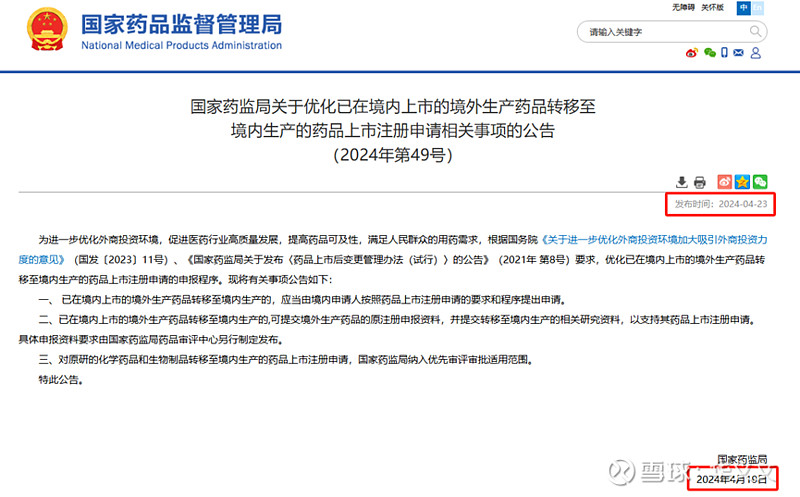
只不过,49号文的具体实施细则是在后来发布的,化学药品是5月9日。当时,上市申请已经提交并获得受理。那么在此之前,华润九新准备的申请材料只能是按照经验尽量准备详细些。此外,还有两种可能,一是在提交申请材料的时候,负责受理的CDE老师在做形式审查工作就已经按照即将发布的申报资料要求告知企业补正,另一种可能是后续在审评过程中要求企业补充提交。
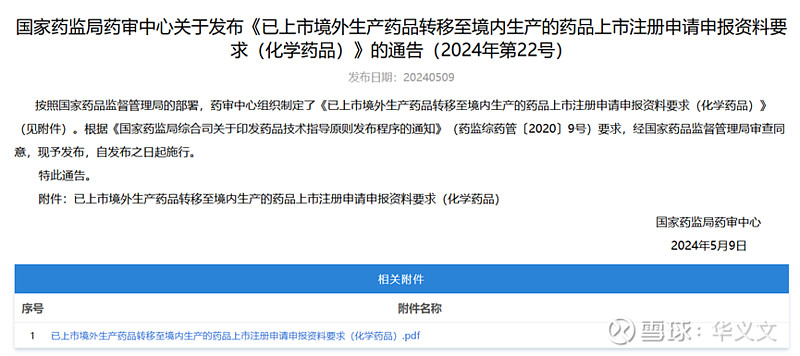
不过,华润九新有了充分时间在5月23日提交优先审评申请,并于今天即5月28日在CDE网站公示。
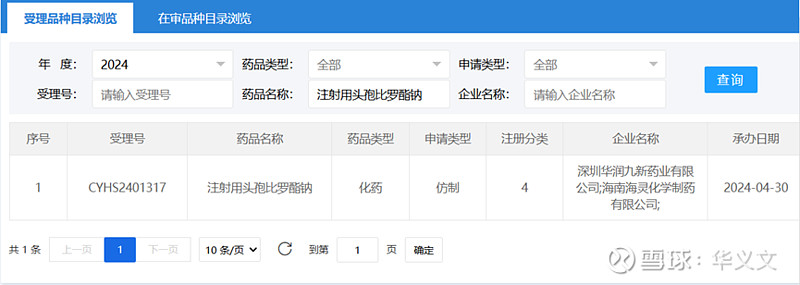
再回过头来看一下此次国产上市申请是按照4类仿制药,这也是法规文件中的要求。在企业一栏除了华润九新之外,还出现了海灵化学,推测华润九新作为上市许可持有人,而海灵化学则是承担生产任务的CDMO。
这里有一个疑问,那就是为何自己不生产而是选择海灵化学,要知道华润九新是给罗氏的注射用头孢曲松钠代工的。可能的解释就是,当下正好产能无法安排。
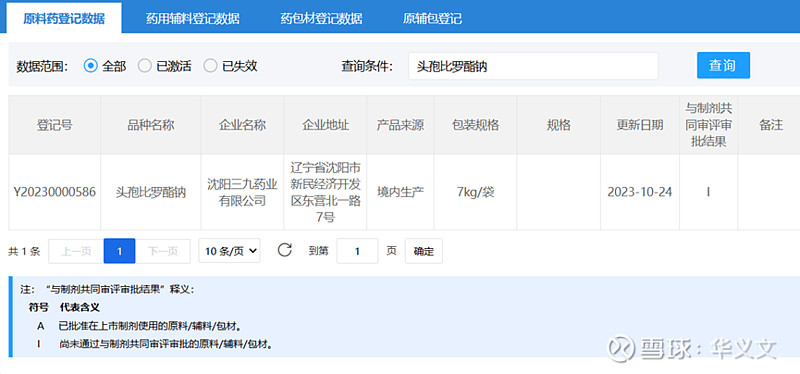
还有一点,既然是实现本地化生产了,那么原料药也必须登记备案了。果然,早在2023年就已经在沈阳三九完成境内生产研究工作并提交登记文件,目前状态是I,等待与制剂关联审评从而激活。
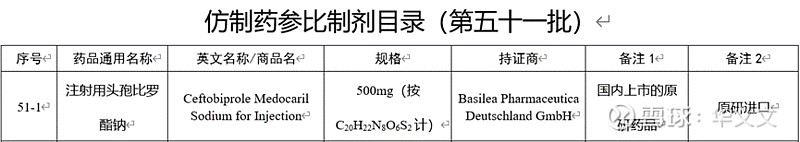
所使用的参比制剂来自目录第五十一批列出持证商是Basilea,其实就是华润九新在2017年从瑞士巴塞利亚(Basilea)引进的品种,华润九新的身份是境内代理。此次国产上市申请就是要使得华润九新的身份成为境内上市许可持有人。也正是因为境外持有人不是华润九新,因此有些申报资料无法按照已上市境外生产药品转移至同一总公司境内持有人/转移至同一总公司境内持有人及生产厂进一步简化。

另外需要指出的是,这次是化学注射剂,按照法规要求:注射制剂需提供注射局部刺激性、过敏性和溶血性试验资料。
以上便是此次申请的基本情况。从近期优先审评公示来看,这也是49号文发布以来的首家申请。原本以为,49号文的初衷是优化外商投资环境加大吸引外商投资力度,鼓励外商投资,将产能放到中国来,最好还能投资建厂,最大受益者应该是外企。但竟然是一家央企有勇气第一个吃螃蟹。作为监管部门来说,也需要实际案例来检验49号文及实施细则的可操作性,也是为后来者提供示范。