
$远大医药(00512)$ $云南白药(SZ000538)$ #核药# #核药诊断# #
【华义文随笔】
当辉瑞、艾伯维、阿斯利康等MNC忙于争夺ADC靶向化疗市场之时,眼看自己追赶无望之下,诺华果断押宝于靶向放射性疗法(RLT,Radioligand Therapy),通常称为核药,并引领全球核药行业发展。
2023年,诺华旗下2款核药在2023年总销售额突破15.8亿美元。
2018年1月批准上市的Lutathera,用于治疗生长抑素受体(SSTR)阳性的胃肠胰神经内分泌肿瘤(GEP-NET)患者,2023年销售额6.05亿美元,同比增长28%;2022年3月批准上市的Pluvicto,用于治疗PSMA阳性转移性去势抵抗性前列腺癌(mCRPC),2023年销售总额达9.8亿美元,同比增长261%。Pluvicto在上市第二年就达到重磅药物水平,这还都是在产能受限的情况下取得的业绩。

得益于产能扩充,确保患者基本上都能按预定日期完成给药。2024年第一季度,Pluvicto继续高歌猛进,同比增长47%,达到3.1亿美元。而Lutathera为1.69亿美元,同比增长13%。

诺华已经将Pluvicto和Lutathera定位核心治疗领域的战略产品进行重点布局。公司预计,Pluvicto的收入峰值将突破20亿美元,而Lutathera的收入峰值也会超过10亿美元。

为了达成这样的收入预期,诺华在积极开展两项关键工作。其一是启动更多临床试验从而扩充这两款核药的适应症。其二是上市申报计划同步建设相应产能,从而应对巨大市场需求。
关于Pluvicto的适应症扩展,诺华的雄心壮志是从二线转移性mCRPC提升到一线疗法。

目前,在针对经ARDT治疗患者的临床试验PSMAfore中,2024年4月诺华公布数据显示Pluvicto显著改善mCRPC患者的总生存期(OS)。公司按计划在2024年下半年提交上市申请。
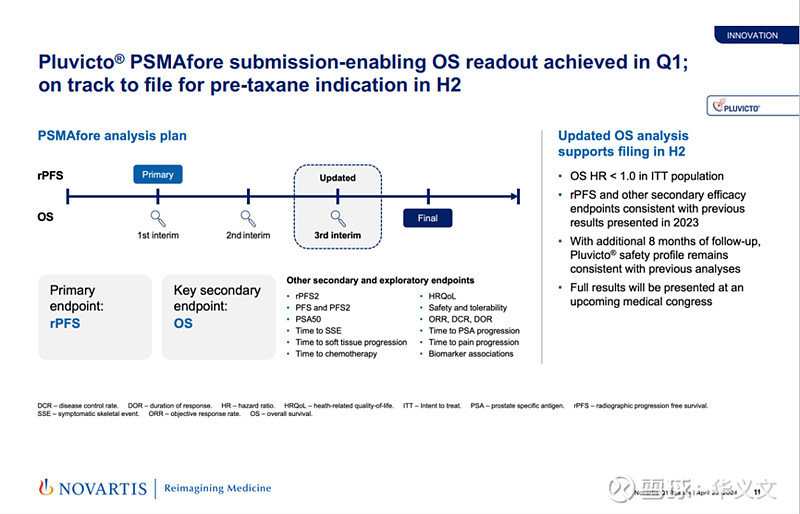
公司下一步计划是将适用人群扩展到转移性激素敏感性前列腺癌(mHSPC)患者。预计这项关键临床试验PSMAddition将在2025年读出数据。

此外,针对前列腺癌患者影像学检查发现存在转移病灶的寡转移性前列腺癌,诺华在2024年第一季度启动3期临床试验PSMA-DC。
以上便是,诺华一步一步在Pluvicto上所做的适应症扩展的临床试验布局。
关于Lutathera的情况。
2018年1月批准上市用于二线治疗胃肠胰神经内分泌肿瘤(GEP-NET);2024年4月,FDA批准将适用人群扩展到12岁以上。此外,诺华计划在2024年上半年向EU提交一线治疗GEP-NET的上市申请。此外,公司也在开展包括脑胶质瘤和小细胞肺癌在内的大瘤种的2期临床试验。

除了Pluvicto和Lutathera这两款上市产品之外,诺华还有5款核药还处于1期临床试验阶段,其中FAP-2286来自于已经破产的Clovis;另外还有10款处于临床前阶段。

除了从Clovis引进项目之外,诺华还在2023年3月与Bicycle签署一份高达17亿美元的合作协议,共同开发针对多个肿瘤靶点的双环肽放射性偶联药物。
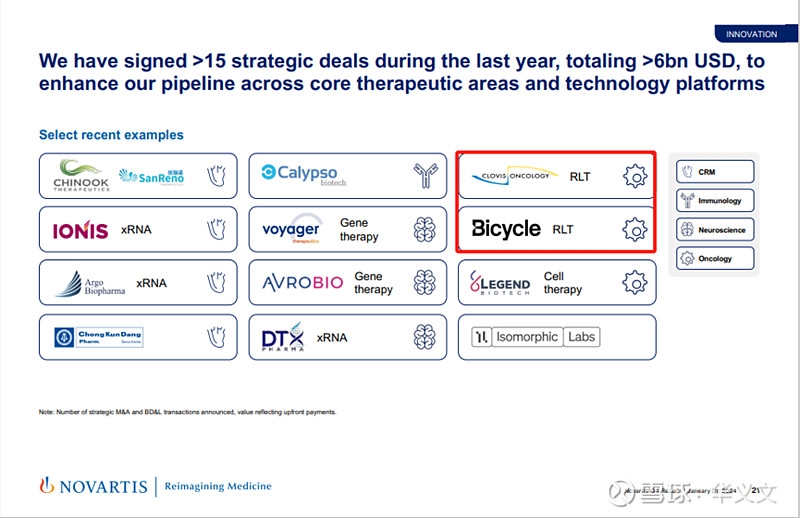
就在上周,诺华继续对外部核药项目继续不惜重金购入。4月30日,诺华延续与Peptidream合作开发环肽靶向偶联核药。此次合作首付款1.8亿美元,此外还有高达27.1亿美元里程碑付款。5月2日,诺华宣布收购以17.5亿美元收购Mariana Oncology,从而获得一款临床前候选核药。
上述是诺华核药两款上市产品的适应症扩展进展,以及其他管线情况。前面提到,除了扩充适应症和研发管线之外,诺华同步也在大力扩充产能。
核药半衰期短的特点,就决定了对生产基地所能覆盖医院的运输距离有严格限制。要么患者尽可能前往生产基地附近的医院,要么生产基地多点布局以便覆盖更多医院,显然后者可以触达更大患者。
因此,为了配合两款核药的上市销售,诺华已经新建了6个核药生产基地,包括2023年4月投入使用的美国Millburn工厂和欧洲Zaragoza工厂,并且在同年第三季度提交了Indianapolis工厂的上市申请。诺华在2023年12月宣布在中国浙江建设核药工厂。此外,也已经确定日本的建厂计划。
公司目标是在2024年起,年产能达到25万剂以上。
