
$石药集团(01093)$ $君实生物(01877)$ #CDMO# #RSV疫苗# #临床试验#
【华义文随笔】
之前提到2024年2月,爱科百发拿到了齐瑞索韦的通知件,未能获得国家局批准上市。虽然爱科百发没有公布原因,不过就其最近登记的临床试验信息来看,应该是和国家局达成一致适当补充一些临床试验病例数即可。
于是,爱科百发于2024年3月重开一个3期临床试验:一项在呼吸道合胞病毒感染的住院婴幼儿中评价多次口服AK0529的有效性、安全性、耐受性和抗病毒作用的随机、双盲、安慰剂对照的III期确认性研究。
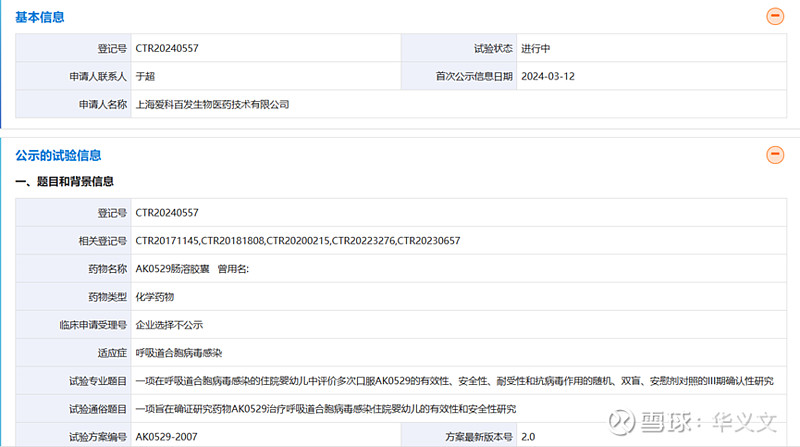
此次临床试验仍然由首都医科大学附属北京儿童医院牵头,共有16家临床机构参与。计划招募100例RSV感染1个月-24个月婴幼儿患者。
鉴于,一个疗程也就是5天且招募患者数量并不多,因此预计此次3期临床试验应该很快就可以完成。爱科百发或许有望在今年底重新递交上市申请。
回过头看,此前递交上市申请所采用的3期临床试验是从2020年9月第一例受试者入组给药。一共入组了302例患者,远大于目标入组249人。考虑到临床试验开展的时间段正好在新冠疫情反反复复,医院对于人员的管理十分严苛,很容易造成受试者脱落,甚至感染新冠病毒。

从牵头单位北京儿童医院伦理委员会一共通过了四个版本伦理批件,尤其是2021年1月到2022年1月期间多次修改,有理由推测临床试验进展的困难,甚至有可能影响临床试验的质量。部分患者的数据有疑问而不能纳入最终统计学计算范围内,最终因为受试者数量不够不能得到具有统计学意义的有效性和安全性。
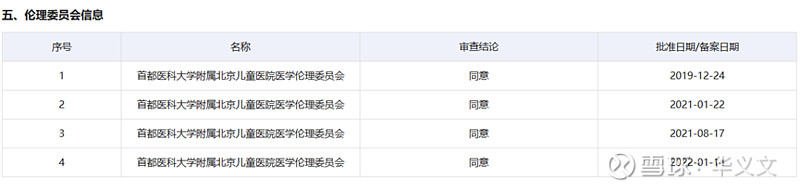
或许这是爱科百发上市提交上市申请被拒的根本原因。此次重开3期临床试验,就是为了补助受试者数量然后重新计算。
与爱科百发直接竞争的是同为口服剂型,来自旺山旺水的VV116氘瑞米德韦干混悬剂,此前在2023年1月获得附条件批准上市用于治疗新冠病毒感染。氘瑞米德韦分子本身其实就是瑞德西韦的氘代版。
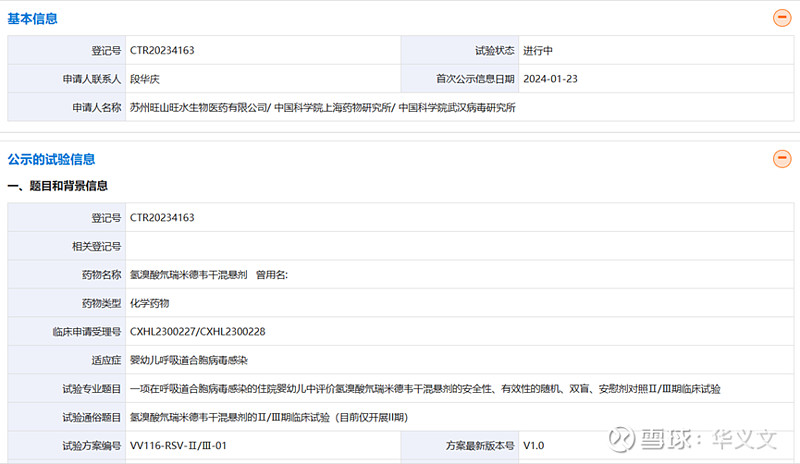
2024年1月,旺山旺水启动了2期临床试验,由李兰娟院士牵头,共18家临床机构,计划入组60例受试者。目前没有公布进展,但估摸着应该是已经完成给药,并在统计数据为启动3期做准备。

目前,从进度上来说,爱科百发是明显放缓,给了旺山旺水追赶时间。不过,如果顺利的话,应该还是会爱科百发先批准上市,不过领先优势可能也就是一年而已。
但是旺山旺水也有其优势。首先,VV116已经有过上市经历,也就是积累了一定范围内人用经验,虽然当时是用于新冠病毒,但至少可以得到更多的安全性数据。第二,VV116使用剂型干混悬剂,对于1-24个月的婴幼儿来说是十分友好的,也有数据表明同时服用婴幼儿配方奶粉对主要代谢产物的生物利用度无显著影响。齐瑞索韦采用剂型是肠溶胶囊,这说明齐瑞索韦必须避开胃液而应当在肠道释放,因此不能打开胶囊将其中微丸喂给患儿,那么问题就是无论多大的胶囊如何让患儿吞咽,不知道临床试验上是如何解决这个问题的。
两款药物未来在市场上表现如何,难以预料。除了两者之间在口服剂型治疗性药物的直接较量,还需要面对赛诺菲预防性抗体药物于2023年底已经在国内批准上市的先发优势。更何况,辉瑞的Abrysvo和GSK的Arexvy也在国内紧锣密鼓开展临床试验,以双方在美国市场硬碰硬的竞争表现来看,也会抢占大部分预防性市场份额,导致发病率锐减从而压缩治疗性市场。更何况,国内还有多家mRNA疫苗也纷纷开展临床试验了。