
剑指抗PD-1/ L1无效尿路上皮癌!首创Nectin-4靶向药获FDA加速审批上市
美国时间12月18日,西雅图遗传学公司(Seattle Genetics)和日本安斯泰来宣布,美国食品药物监督管理局(FDA)已加速批准PADCEV™(enfortumab vedotin-ejfv),用于治疗先前患有局部晚期或转移性尿路上皮癌的成年患者——这类患者在(新辅助)手术前或(辅助)手术后或局部进展或癌症转移背景下接受过PD-1/PD-L1抑制剂和铂类化疗治疗(尿路上皮癌是膀胱癌的一种)。
PADCEV是FDA在美国批准的首个治疗这类患者群体的疗法,同时也是直接靶向尿路上皮肿瘤高表达蛋白Nectin-4的首创抗体药物偶联物(ADC)。
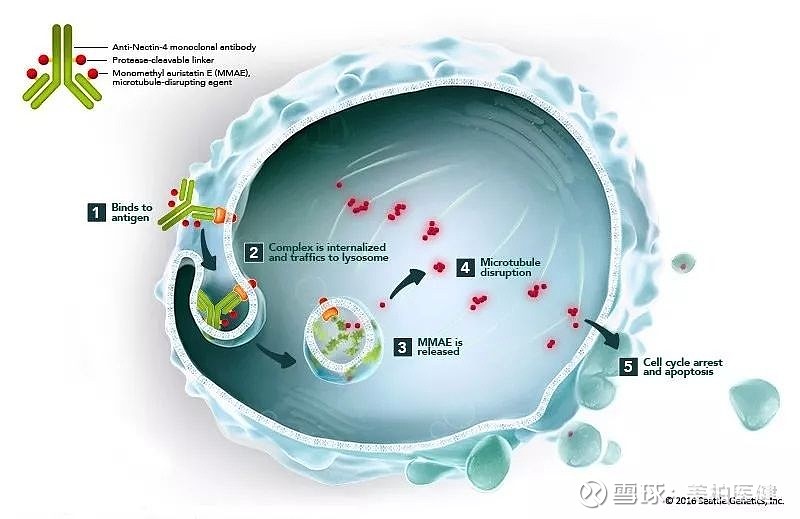
▲ PADCEV™(enfortumab vedotin-ejfv)作用机制示意图
* 疗效数据
PADCEV此次获得加速审批主要基于关键试验EV-201的积极结果。EV-201试验是一项单臂II期多中心试验,共纳入125例局部晚期或转移性尿路上皮癌患者,这些患者之前接受过PD-1/PD-L1抑制剂和铂类化疗的治疗。
◆ 试验的主要终点——确认总缓解率(ORR)达到44%(55/125)。
◆ 在接受PADCEV单药治疗的患者中,12%(15/125)的患者达到完全缓解(CR),这意味着在评估时无法检测到肿瘤;
◆ 32%(40/125)的患者达到部分缓解(PR),这意味着肿瘤缩小。
◆ 次要终点——中位缓解持续时间(DoR)达到7.6个月。
此外,PADCEV一项全球性的III期随机对照验证性试验EV-301正在进行中,并计划在其他国家申请上市。
* 安全性
◆ 最常见的严重不良反应为尿路感染(6%)、蜂窝织炎(5%)、发热性中性粒细胞减少(4%)、腹泻(4%)、败血症(3%)、急性肾损伤(3%)、呼吸困难(3%)和皮疹(3%)。
◆ 最常见的导致停药的不良反应是周围神经病变(6%)。
◆ 最常见的不良反应是疲劳(56%)、周围神经病变(56%)、食欲下降(52%)、皮疹(52%)、脱发(50%)、恶心(45%)、味觉异常(42%)、腹泻(42%)、干眼症(40%)、瘙痒(26%)和皮肤干燥(26%)。
◆ 最常见的3级以上不良反应为皮疹(13%)、腹泻(6%)和疲劳(6%)。
“转移性尿路上皮癌是一种高度侵袭性肿瘤,可选治疗方案有限,PADCEV的获批对这些患者来说是具有重要意义。”纪念斯隆·凯特林癌症纪念中心泌尿生殖肿瘤内科主任Jonathan E. Rosenberg博士表示,“PADCEV的临床试验纳入了一系列难治性尿路上皮癌患者,包括那些已经扩散到肝脏的患者。”
“PADCEV的获批是对膀胱癌患者的福音,”膀胱癌支持组织Bladder Cancer Advocacy Network首席执行官AndreaMaddox-Smith说,“尽管近年来新的膀胱癌疗法已经获批,但大多数晚期膀胱癌患者面临着艰难的旅程,几乎没有治疗选择。”

Keytruda获FDA咨询委员会支持,有望治疗特定高危膀胱癌
默沙东的明星抗癌药Keytruda可能很快会在药品说明书上增加新的膀胱癌适应症,这要感谢FDA资讯小组的支持。
近日,FDA肿瘤药物咨询委员会的专家以9票赞成、4票反对的票数支持Keytruda用于治疗对标准卡介苗(BCG)治疗无效的高风险非肌肉浸润性膀胱癌(NMIBC)。
FDA咨询委员会的支持使Keytruda有望在明年1月成为首款获批用于治疗NMIBC的PD-1/L1抑制剂类药物,领先于包括百时美施贵宝(BMS)的Opdivo、罗氏的Tecentriq和阿斯利康的Imfinzi在内的竞争对手,这些公司的PD-1/L1抑制剂也在类似的NMIBC人群中接受测试。
FDA咨询委员会肿瘤学专家主要根据II期试验的完全缓解率(CR)数据做出决定:在Keynote-057研究中,在接受Keytruda治疗3个月后, 41%的患者癌症症状消除,中位缓解持续时间为16.2个月,其中46%在一年内没有癌症症状。
* 支持声>反对声
不过,投资银行SVB Leerink的分析师Daina Graybosch在周三给客户的报告中指出,一年后所有受试者中有19%维持肿瘤清除状态,低于国际膀胱癌组织(IBCG)推荐的30%标准。
但IBCG主席兼MD安德森癌症中心泌尿肿瘤学家Ashish Kamat选择为Keytruda辩护,他认为,这个数字是从更广泛的人群中计算出来的,与参与Keytruda试验的人群并不完全相同,也不是一个硬门槛。
一些FDA咨询委员会成员还指出,受试者的浅表癌或原位癌是通过一种不太敏感的膀胱镜即普通白光膀胱镜来确定的,他们认为这可能提高了Keytruda的完全缓解率。但考虑到更精确的蓝光膀胱镜检查成本太高,无法被广泛采用,“研究结果据称反映了真实世界的经验。”Graybosch说。
支持Keytruda的观点也被提出,包括Keytruda持久的完全缓解率,这似乎比Endo公司的 Valstar (valrubicin)更好,valrubicin是目前唯一一款被特别批准用于BCG无应答原位膀胱癌的药物。
对于对卡介苗没有应答的NMIBC,癌细胞可能会侵袭膀胱壁的肌肉层。为了防止进一步的转移,这些患者的黄金治疗标准是切除膀胱,这是一种有时会导致残疾甚至死亡的侵入性手术。
据估计,2018年美国新增的81190例膀胱癌病例中,约75%被归类为NMIBC。据此,Graybosch预计,如果FDA遵循资讯委员会的建议,并在2020年1月批准Keytruda用于治疗NMIBC,那么Keytruda在美国的最高年销售额将达到2.5亿美元。
默沙东目前已经在进行III期Keynote-676研究,以进一步确认Keytruda对NMIBC的疗效。这项研究正在探索Keytruda + 卡介苗,对卡介苗治疗后持续或复发的高危NMIBC患者的疗效。
* 对手
其他竞争对手包括Ferring Pharma的子公司FerGene,其基因治疗nadofaragene firadenovec也正处于FDA优先审查状态。几天前的III期试验结果显示,该药可使53%的卡介苗无反应高危NMIBC患者达到肿瘤清除,24%的患者在一年后仍保持完全缓解。

提前预警疾病!Seer公司志在将蛋白质组学血液检测推向市场

▲Seer 首席执行官(CEO)兼联合创始人Omid Farokhzad
对创立于美国明尼苏达州的初创公司Seer来说,2019年是关键性的一年,它花了整整一年时间建设其蛋白质组学平台。现在,该公司正着眼于2021年的市场投放,利用D轮融资刚获得的5500万美元,以继续推进其蛋白质组学技术,并加强其商业团队和基础设施建设。
一年前,Seer凭借3600万美元融资走出阴影,致力于开发癌症和神经系统疾病的早期预警血液检测平台。
一年后,Seer再次获得5500万美元的D轮融资。Seer致力于在蛋白质组学范畴研究蛋白质及其功能,就像下一代测序在基因组学中所做的那样。
“2007年,当Illumina公司推出下一代测序(NGS)技术时,我们实际上可以看到整个基因组,不仅是你所知道的重要片段,还有一切。目前NGS已实现了速度可观的批量化测序,因此,你可以查看整个基因组。” Seer 首席执行官(CEO)兼联合创始人Omid Farokhzad表示,“蛋白质组学领域也拥有类似的潜质。”
Seer由Farokhzad和首席商务官兼总裁Philip Ma以及麻省理工学院(MIT)的研究所教授Robert Langer共同创立,Langer是该公司科学顾问委员会的主席。
Seer公司的蛋白质图谱平台结合了纳米技术、蛋白质化学和机器学习算法,对从个体样本采集到的蛋白质中的数万个数据点进行分析。它的目的是同时从多个病人身上获取这些信息,并使用人工智能(AI)系统对数据进行分析。
基于此,这项技术未来有望在人群层面洞察疾病的发展,然后用于血液检测,目的是在症状出现之前就发现疾病。Seer公司计划在2021年推出首个用于研究和临床的“疾病早期预警”血液检测。

文章版权归【美柏医健】所有
欢迎转发,转载请参照“转载须知”
投稿或应聘,请将稿件和简历发送到
tara.tian@mybiogate.com
近期热文推荐

最新活动推荐

点击阅读原文,注册报名聚焦中国论坛·旧金山站活动