ATYR1923 临床试验设计可以很好地模拟真实世界。
试验设计:ph 1b/2a 研究 (NCT03824392) 是一项随机 (2:1)、双盲、安慰剂对照、多递增剂量试验,在 37 名经组织学证实为 PS ≥6 个月的患者中进行,包括三组测试剂量 1.0 mg/kg、3.0 mg/kg 和 5.0 mg/kg ATYR1923(每月静脉内给药)或安慰剂超过 24 周,在此期间,患者在第 8 周前将类固醇减至 5.0 mg/kg,并在第 16 周减至 0 mg。
基线特征:该研究包括必须稳定口服泼尼松(10 至 25 mg/天)≥4 周的 PS 患者,同时排除具有临床意义的心血管、肝脏、其他主要器官受累和具有晚期纤维化表现的患者。 该研究还排除了接受生物免疫调节剂治疗的患者。
主要终点:安全性/耐受性的主要终点满足截至第 24 周的临时安全性读数。
关键功效:5 mg/kg 组实现了:(i) 第 24 周从基线总体类固醇减少 58%,减量后类固醇使用相对减少 22%; (ii) 33% 的患者完全停止使用类固醇; (iii) 在第 24 周肺活量 (FVC) 绝对改善+3.3%,具有临床意义; (iv) 在所有结节病症状测量中都观察到了具有临床意义的改善,包括呼吸急促、咳嗽和疲劳。 遗憾的是,由于疫情导致数据不完整,无法评估肉芽肿的 FDG-PET 扫描结果。
如下图:基线特征显示治疗组的疾病持续时间更长
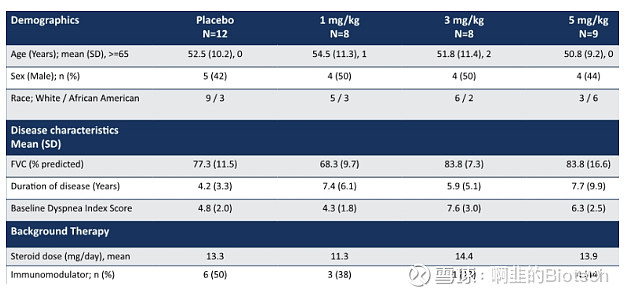
(图片来源:公司报告)
我对 ATYR1923 在 PS 中的 ph2 数据的总结:
ATYR1923 不仅是一种减少类固醇使用的药物,而且可能是一种改善疾病的突破性药物。
ph2 试验在类固醇使用、FVC改善、症状改善和生物标志物方面实现的剂量依赖性支持 ATYR1923 的强大功效和将5 mg/kg进一步推进。另外较低的剂量也显示出活性。我认为症状和类固醇相关负担的减轻可以让患者迅速感觉好转。ATYR1923与目前批准的因安全问题而停药率高的 IPF 药物相比,效果更好。
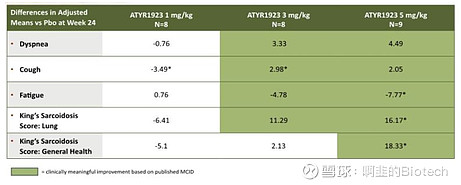
(图1: 症状改善;来源:公司报告)
FVC 的 +3.3% 绝对改善(安慰剂为 -0.08%)具有临床意义且令人印象深刻。考虑到这仅仅是一项短期研究,并且实验对象是已经对类固醇治疗稳定的患者,我觉得ATYR1923可能会给未接受类固醇治疗的患者带来更大好处。我们看到早期治疗证明了 ATYR1923 的作用机制是有效的,这些数据也支持将临床试验扩大到慢性过敏性肺炎、结缔组织病相关间质性肺病和其他炎症驱动的间质性肺病(ILD)治疗,这些 ILD 可通过减少炎症来阻止其进展为纤维化,其中 FVC 已经建立了经过验证的疗效终点。
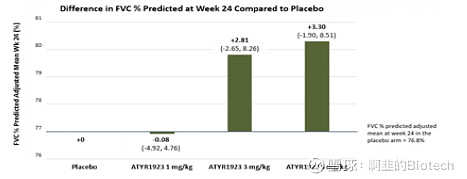
(图2: FVC % 绝对改善;来源:公司报告)
ATYR1923 FVC 数据特别令人印象深刻,因为这些类固醇依赖患者的类固醇逐渐减少预计会导致疾病复发和 FVC 减少。 3.3%的数据也高于 +2% 的参考值(因为在特发性肺纤维化中看到的肺功能改善的最小临床意义为2%)。炎症和结节病生物标志物(IL-6、MCP-1、IFN-γ、IP-10、TNFa、ACE、IL-2Ra 和 SAA)的改善趋势证实了 ATYR1923 的疗效。
ATYR1923 的疗效随着剂量增加而增加,但其安全性似乎并没有变化。未观察到与药物相关的严重不良事件或抗药物抗体。我认为这种情况对使用其他药物的合并症患者有利。有人可能想知道 ATYR1923 是否可以在更高剂量下获得更好的疗效。 我认为,由于 ATYR1923 在其小鼠研究中的最高未观察到不良反应水平 (NOAEL) 为 60 mg/kg,根据 FDA 指南,这相当于约 5 mg/kg 人用剂量,aTyr 必须进行额外的研究以证明其合理性 和更高剂量的安全性,我认为aTyr不太可能进行这项研究。
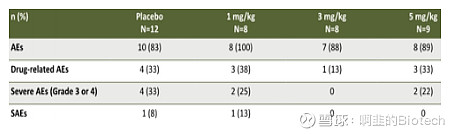
(图2: 安全性概况;来源:公司报告)