
癌症治疗是全球医学研究的重点之一,而肿瘤治疗方法的每一个进步都会牵动着全人类的心。作为临床肿瘤领域的奥林匹克盛会,第59届美国临床肿瘤学会(ASCO 2023)年会于美国时间6月2-4日再次到来。今年的主题是“与患者合作:癌症治疗与研究的基石(Partnering With Patients: The Cornerstone of Cancer Care and Research)”,肿瘤治疗技术的发展都是为了患者,也离不开每一位参与临床研究患者的贡献。其中,乳腺癌作为全球发病最高癌种的临床治疗研究进展备受关注。
在6月4日举行的转移性乳腺癌环节中,嘉和生物旗下来罗西利(Lerociclib,GB491)以壁报讨论(Poster Discussion Session)形式展示了细胞周期蛋白依赖性激酶 (CDK) 4/6抑制剂来罗西利 (Lerociclib,GB491) 联合氟维司群(Fulvestrant) 治疗HR+/HER2-晚期乳腺癌患者的III期临床研究LEONARDA-1 的数据。
而在此前,ASCO 2023官网于5月25号在Daily News板块刊登了题为“来罗西利/氟维司群可降低晚期HR阳性/HER2阴性乳腺癌的疾病进展风险”的文章。Daily News报道中展示了LEONARDA-1 III期临床研究的数据,并大量引用了该研究牵头人、中国工程院院士、中国医学科学院肿瘤医院肿瘤医学教授、医学博士徐兵河院士的观点。
根据ASCO官网显示,今年大会总共收录并展示了来自全球各地共2,900余份报告摘要。而依据往年的经验,在所有展示摘要中,仅有不足20%的报告会在层层筛选后,入选Daily News,足见2023 ASCO大会主办方及委员会对LEONARDA-1 研究数据的高度认可。
差异化优势,来罗西利展现良好临床效果
LEONARDA-1研究是一项比较来罗西利(Lerociclib,GB491)联合氟维司群(Fulvestrant)与安慰剂联合氟维司群的III期临床试验。截至2022年12月的数据显示,研究组的临床试验主要终点无进展生存期(PFS)显著优于对照组。
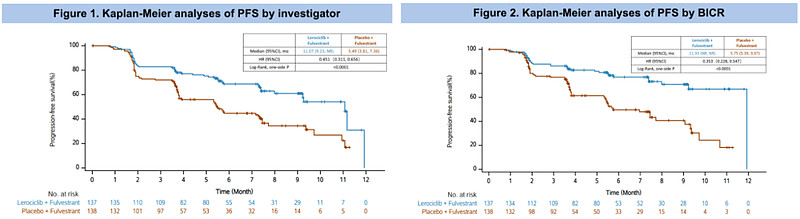
基于研究者评估和BICR评估的疗效数据(来源ASCO官网)
从上图可以看出,基于研究者评估的研究组中位无进展生存期(mPFS)为11.07个月,安慰剂组为5.49个月,患者疾病进展或死亡风险显著降低约55%(HR 0.451, P<0.0001)。基于盲态独立影像评估BICR结果与研究者评估保持一致,研究组PFS为11.93个月,安慰剂组为5.75个月,患者疾病进展或死亡风险降低约65%(HR 0.353, P<0.0001)。
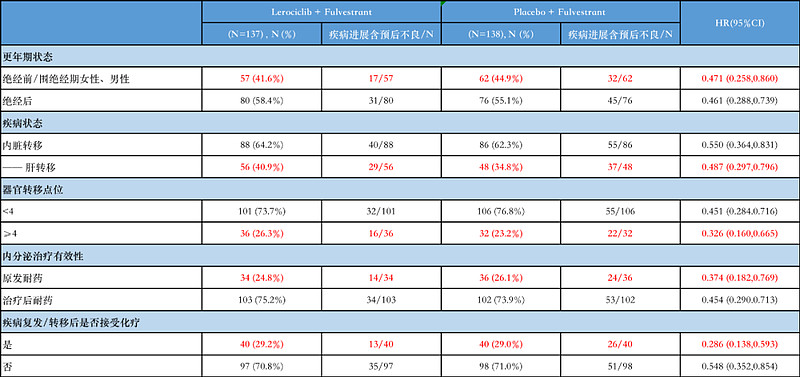
患者亚组的PFS分析(来源ASCO官网)
在患者的不同亚型分组数据中,同样观察到了研究组来罗西利联合氟维司群的良好疗效。在这些临床常见且预后较差的患者人群中,来罗西利联合氟维司群临床获益显著,如绝经前/围绝经期的患者HR为0.471,肝转移患者的HR为0.487,原发性内分泌耐药患者的HR为0.374,有4个以上器官转移点位患者的HR为0.326,肿瘤复发/转移后接受过一线化疗药物治疗的患者HR为0.286。相比安慰剂组大大降低了疾病进展或死亡风险。
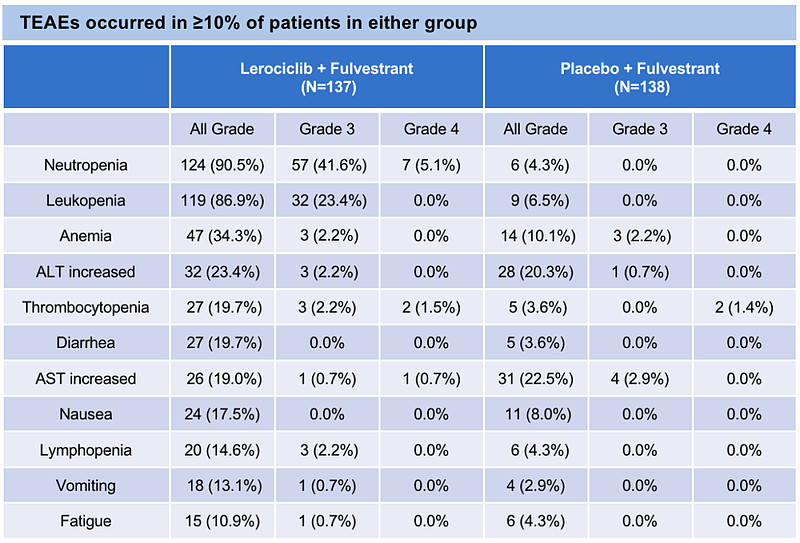
治疗后出现的不良事件汇总(来源:ASCO官网)
LEONARD-1研究也展现了来罗西利(Lerociclib,GB491)在安全耐受性方面的优势。来罗西利(Lerociclib,GB491)骨髓抑制较轻,研究组的4级中性粒细胞减少发生率较低 (5.1%),未观察到发热性中性粒细胞减少症。整体发生腹泻的比率仅有19.7%,且未观察到3/4级腹泻病例。来罗西利(Lerociclib,GB491)与安慰剂组相比,未增加肝毒性和心脏毒性,皮疹发生率在4%左右,与安慰剂组类似。本研究也未报告血栓栓塞事件。这与来罗西利(Lerociclib,GB491)在美国开展的II期临床的安全性数据一致。临床易于管理,患者耐受性更佳。
来罗西利(Lerociclib,GB491)出色的疗效和安全耐受性为HR+/HER2-晚期乳腺癌患者提供了更可靠的临床选择。尤其对于难治预后差人群,以及化疗后骨髓抑制恢复不佳、胃肠/肝功能不佳或耐受性差的患者,来罗西利(Lerociclib,GB491)将成为首选的CDK4/6抑制剂。
2023年3月28日,来罗西利(Lerociclib,GB491)的二线临床试验达到主要临床终点,正式完成NDA提交,成为第二个国内企业上市许可申请获得药监局受理的CDK4/6抑制剂。
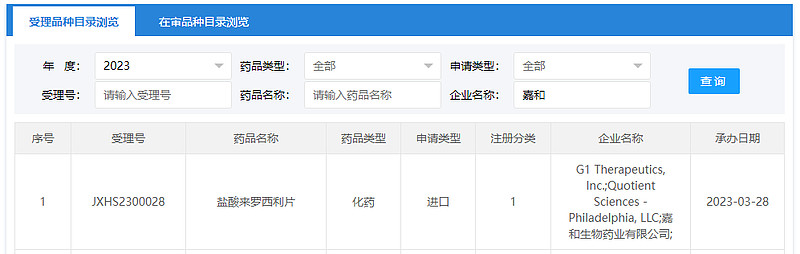
来源:CDE官网
本项研究的主PI徐兵河院士认为,来罗西利(Lerociclib,GB491)为乳腺癌患者提供了有效的治疗选择,具有潜在同类药物最佳安全性,将成为HR+/HER2-晚期乳腺癌患者在现有治疗方案基础上的重要补充。
标准治疗外,疗效及安全性优势为实现不间断的连续用药、获得更佳临床获益提供可能
根据世界卫生组织国际癌症研究机构(IARC)发布的2020年全球最新癌症负担数据,2020年中国乳腺癌新发病例数为42万,位于肺癌、结直肠癌、胃癌之后的第四位。
越来越多CDK4/6抑制剂临床结果的公布,奠定了CDK4/6抑制剂在HR+/HER2-晚期乳腺癌患者治疗中的“王者地位”。特别是对于内分泌治疗的敏感人群,CDK4/6抑制剂是首选和优选,成为HR+/HER2-晚期乳腺癌患者的标准治疗。

来源:弗若斯特沙利文
不幸的是,CDK4/6通常与不良反应相关,如血液学毒性、胃肠道毒性、肝功能异常、静脉血栓栓塞和皮肤不良反应。这些限制了CDK4/6抑制剂在乳腺癌患者群体中的临床应用。
“基于目前未满足的医疗需求,我们希望开发一种CDK4/6抑制剂,它不仅有效,而且具有显著的安全性优势,可以改善患者的生活质量,这对乳腺癌患者至关重要,具有非常有意义的临床价值。”徐兵河院士对于来罗西利(Lerociclib,GB491)这款疗效优异且安全性佳的CDK4/6抑制剂充满期许。“在中国开展的LEONARDA-1临床试验有助于填补来罗西利如何用于改善既往内分泌治疗失败的乳腺癌患者的生存和安全性的治疗空白。”
基于LEONARDA-1研究所展现的疗效及安全性数据,ASCO Daily News明确指出,LEONARDA-1研究的有利结果将对未来(在美国)的III期临床试验带来启示。
目前被美国食品药品监督管理局(U.S. Food and Drug Administration, FDA)批准用于治疗HR+/HER2晚期乳腺癌的CDK4/6抑制剂只有阿贝西利(Abemaciclib)、帕博西尼(Palbociclib)和瑞博西林(Ribociclib)。但是,LEONARDA-1研究的有利结果将对未来(在美国)的III期临床试验带来启示,并有助于扩大这一名单,最终将Lerociclib(GB491)纳入其中。
CDK4/6抑制剂带来乳腺癌市场的不断增长
根据一篇来自Nature Reviews Drug Discovery上文章的数据显示2019年乳腺癌市场总额为202亿美元,其中HER2靶向药物和CDK4/6抑制剂占销售额的68%。全球乳腺癌市场到2029年可达500亿美元,保持9%的年复合增长率。其中,随着CDK4/6抑制剂新药的逐渐获批结合适应症的拓展,CDK4/6抑制剂在2029年的预计销售额将达到200亿美元,占据乳腺癌市场的半壁江山。
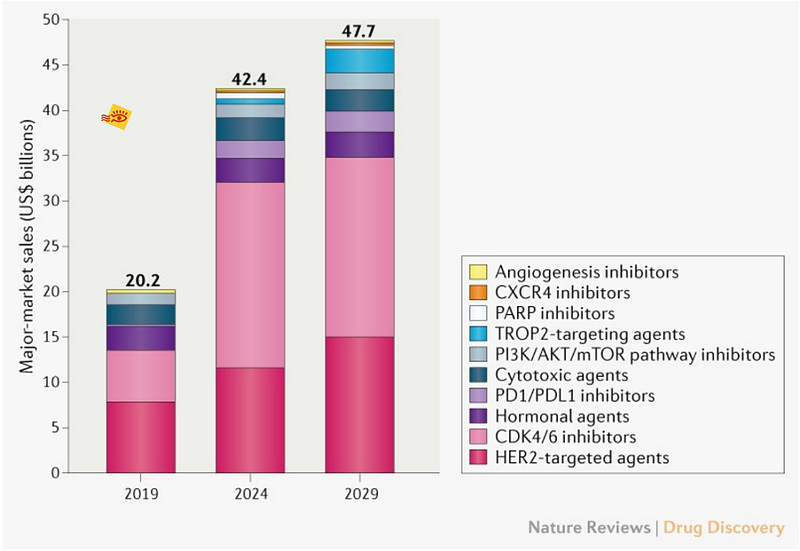
按药物类别估计的乳腺癌关键疗法的主要市场销售额。该图显示了美国、法国、德国、意大利、西班牙、英国和日本七大市场2019–2029年的预测。(来源:网页链接))
在中国,根据国家癌症中心发布的《中国乳腺癌筛查与早诊早治指南》,我国女性乳腺癌发病高峰年龄段为45-50岁,平均比西方国家早10年左右。意味着大量乳腺癌患者人群是边工作边治疗。而其中,近2/3的乳腺癌患者被诊断时即为晚期(ABC),且70%为雌孕激素受体(HR)阳性(HR+),是患者治疗需求巨大的乳腺癌药物市场。
HER2+乳腺癌在2022年仅院内渠道销售额就超过40亿人民币,如果包含院外市场,预估全年销售在70亿人民币规模。此外,HER2+治疗药物曲妥珠单抗的标准治疗时间是一年,而HER2阴性患者各线标准治疗时间是1-2年。
对标HER2+的乳腺癌市场,HR+HER-人群更为广泛、治疗时间更长,作为HR+/HER2-晚期乳腺癌患者标准治疗的CDK4/6抑制剂在中国市场预计将达到百亿以上人民币规模。而具有差异化的疗效与安全耐受性优势的来罗西利(Lerociclib,GB491)上市后,必将拥有良好的市场前景,打开CDK4/6抑制剂市场的新格局。
国内目前在HR+/HER2-晚期或转移性乳腺癌领域,已上市四款CDK4/6抑制剂。
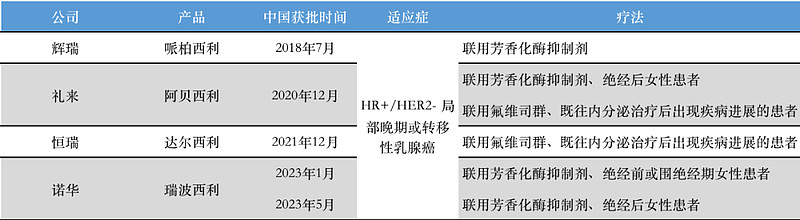
资料来源:CDE官网
根据可查询的公司财报数据显示,哌柏西利由于全球第一个上市的优势以及良好的治疗效果销售额远远领先。从2020开始随着CDK4/6抑制剂新药的陆续上市,哌柏西利销售额有一定下滑,但整体市场持续增长。哌柏西利专利已经于2023年1月10日到期,后续仿制药也将开始加入市场竞争。
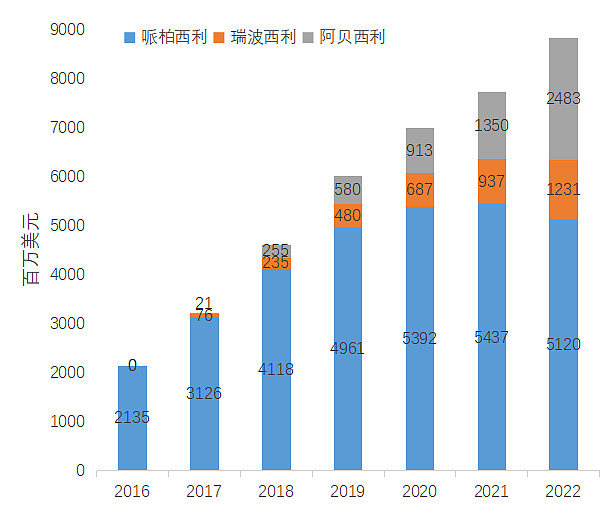
哌柏西利,瑞博西利和阿贝西利2016-2022年销售额(来源各公司财报)
可以预见的将来,CDK4/6抑制剂的临床研究方向将从晚期适应症跨越到早期,从新辅助/辅助到复发/转移后的多元化选择,以及CDK4/6抑制剂与更强的内分泌疗法的联用。而疗效优异、安全性佳的CDK4/6产品差异化优势将会得到市场的正确反馈。
来罗西利的多元化研究方向,未来可期
从2013年到2023年针对HR+/HER2-晚期乳腺癌的各项临床研究中,包括PALOMA系列、MONARCH系列、MONALEESA系列及国内的DAWNA系列和LEONARDA系列,都在不断地取得良好的结果。
本次ASCO会议上,嘉和生物旗下来罗西利 (Lerociclib,GB491) LEONARDA-1研究显示的不间断连续服药方式,以及对胃肠道、心脑血管、免疫系统更高的安全性将对中国更年轻且更易复发/转移的乳腺癌患者提供更好的治疗选择。
而基于良好的安全性,后续作为联用药物开发平台,不仅是与各种内分泌药物,后续在与免疫检查点抑制剂联用的过程中都将可能发挥出优秀的效果。
我们也期待来罗西利 (Lerociclib,GB491)后续更长时间的患者随访数据及在其他适应症中的扩展。