
癌症是严重威胁人类健康和生命的疾病,已有研究从人类超过2万种蛋白质中,筛选了600多种蛋白质,证实在各种癌症发生及进展中有重要功能,其中包括近400种非酶蛋白,使用现在占位驱动的药物开发方法,非酶的靶点多数被称之为“不可成药”的靶点。
小分子靶向蛋白质降解药物(Targeted protein degradation,TPD)的开发,最新几年取得很多进展,包括分子胶和异双功能降解药物,如蛋白质水解靶向嵌合体(proteolysis-targeting chimeras,PROTACs)。通过直接降解靶蛋白,使得靶向以前被认为“不可用药”的蛋白质成为可能。异双功能降解药物,一端连接感兴趣的蛋白(protein of interest ,POI),另外一端连接E3连接酶。
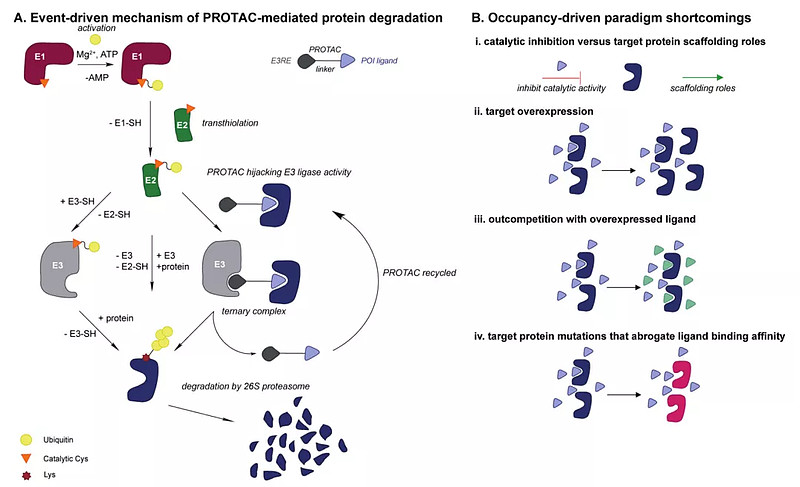
PROTACs和传统占位驱动药物开发模式的差异(Current Opinion in Chemical Biology 2019, 50:111–119)
但是和所有的药物开发技术类似,PROTACs也存在着不小的挑战。比如E3连接酶配体的缺乏,以及肿瘤突变等进化的耐药性,以及非特异性作用引起的毒性等。
耐药性
PROTACs降解药物对E3连接酶的依赖,肿瘤细胞通过损害E3连接酶成分功能,来产生耐药性。事实上,研究证明,在长时间治疗后,肿瘤细胞获得了对VHL招募和CRBN招募PROTACs的耐药性。
对PROTACs的获得性抗性主要是由基因组的改变或CRBN基因或CUL2基因的表达显著减少引起的,而不是针对参与结合POI和E3连接酶的残基的点突变。CRBN的基因组缺失也被发现是骨髓瘤细胞对IMiDs产生抵抗的主要原因。
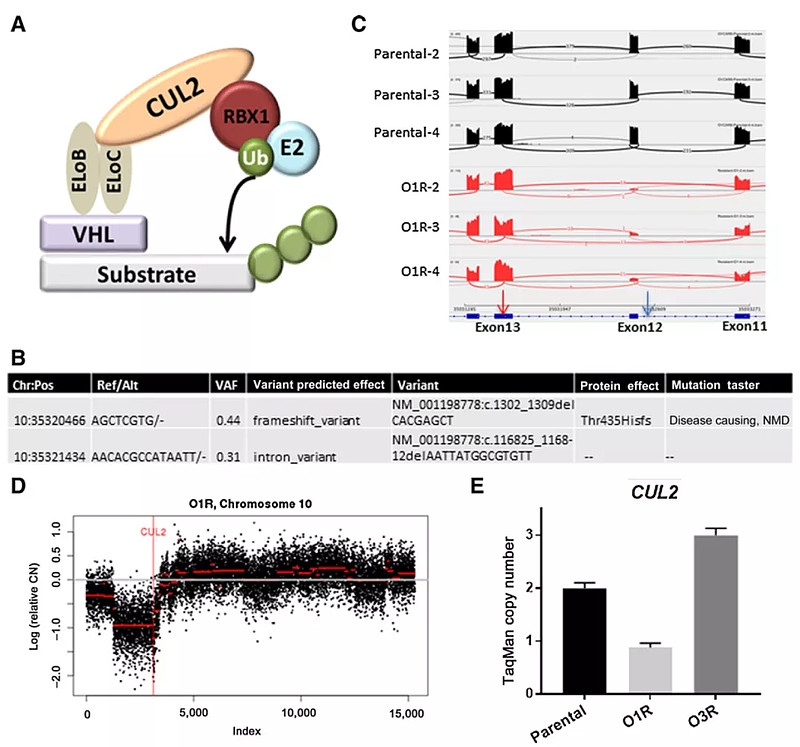
耐药细胞CUL2基因突变或者删除(Mol. Cancer Ther. 18, 1302–1311 (2019).
基于三种不同E3连接酶CRL2VCHL、CRL4CRBN和CRL4DCAF15的全基因组CRISPR-Cas9敲除筛选显示,CRBN、VHL和DCAF15的缺失介导了对PROTAC耐药性。研究提示,肿瘤通过介导其非必需E3连接酶的突变,获得对于PROTAC的耐药。使用RNAi研究,8种用于PROTAC的E3连接酶,至少5种对于肿瘤细胞功能是非必需的。
研究显示,对于CRBN-PROTACs和VHL-PROTAC耐药的基因改变没有重叠,因而交替使用招募不同E3连接酶的PROTACs可能是克服耐药的途径之一。
毒性
药物毒性是限制治疗药物有效性的主要因素。在TPD领域,免疫调节性亚胺药物(immunomodulatory imide drugs IMiDs)的毒性是一个值得关注的问题。Thalidomide在20世纪50年代末获得批准治疗多发性骨髓瘤,但在发现它导致广泛(超过1万)严重的出生缺陷后被禁止,此外还可以引起过敏性皮疹,中性粒细胞减少和心律失常。
一些毒性作用被认为是由IMiDs介导的CRBN新底物(neosubstrates)降解引起的。MDM2配体如nutlin3最初通过抑制MDM2-p53的相互作用被发现为MDM2拮抗剂和p53激活剂。虽然临床前研究和早期临床试验表明nutlin3治疗癌症的疗效,但其p53在正常细胞中p53激活导致的剂量限制靶毒性,仍然是推进nutlin3作为单一治疗药物的重大挑战。
磺胺类药物是DCAF15配体,可诱导RNA剪接因子如RBM39的降解,RBM39在许多细胞类型中是必不可少的;与此一致的是,在临床试验中观察到剂量限制毒性。
然而,BIRC2配体bestatin和RNF114配体nimbolide在临床应用中似乎都具有低毒性和相对积极的安全性。鉴于目前E3配体的缺乏及其局限性,TPD领域迫切需要开发具有低毒性的新型E3配体。
E3连接酶的新底物
虽然没有VHL的新底物的报道,但许多IMiD-CRBN复合物的新底物已被报道,其中许多含有乙炔锌指脱基序。翻译终止因子GSPT1可能是最令人担忧的新底物,由于GSPT1在大多数细胞中起关键作用,因此GSPT1可能被招募CRBN的PROTACs降解,有潜在的毒性。
首次有报道称GSPT1被MI-389(CRBN招募的PROTAC,泛激酶抑制剂sunitinib作为POI结合剂)无意中降解,而预期的靶点KIT没有被降解。由于GSPT1在翻译中的关键作用,通过CRBN招募的PROTAC降解GSPT1可能导致POI的降解作为次要效应。据报道,CRBN招募PROTACs可以降解其他CRBN新底物。例如,CDK4和CDK6 PROTACs可以降解淋巴样转录因子IKZF1和IKZF3,这是CRBN招募IMiDs的两种新底物,在杀死套细胞淋巴瘤细胞方面的效果明显高于单独降解CDK4和CDK6。因此,确定CRBN招募PROTACs的新底物降解谱是至关重要的,以排除次级药物反应。
此外,DCAF15和DDB1-CDK12的新底物RBM39和CyclinK分别在许多细胞类型中都是必不可少的;因此,确定DCAF15招募和DDB1-CDK12招募PROTACs的新底物降解谱是很重要的。
小编总结
作为“不可成药” 靶点的希望,PROTACs最近两年获得了较大进展,也受到了资本市场的关注。当然除了众所周知的优势,PROTACs也存在一些挑战,比如耐药性和毒性。PROTACs的耐药主要是E3连接酶及相关基因的表达下降或者删除引起,而毒性主要是因为E3连接酶作用于新的底物,降解了其他分子,引起不可控的副作用。
参考文献
1.Stacey-Lynn Paiva and Craig M Crews,Targeted protein degradation: elements of PROTAC design,Current Opinion in Chemical Biology 2019, 50:111–119
2.Behan, F. M. et al. Prioritization of cancer therapeutic targets using CRISPR-Cas9 screens. Nature 568, 511–516 (2019).
3.Lai, A. C. & Crews, C. M. Induced protein degradation: an emerging drug discovery paradigm. Nat. Rev. Drug Discov. 16, 101–114 (2017).
4.Zhang, L., Riley-Gillis, B., Vijay, P. & Shen, Y. Acquired resistance to BET-PROTACs (proteolysis-targeting chimeras) caused by genomic alterations in core components of E3 ligase complexes. Mol. Cancer Ther. 18, 1302–1311 (2019).
5.Assi, R. et al. Final results of a phase 2, open-label study of indisulam, idarubicin, and cytarabine in patients with relapsed or refractory acute myeloid leukemia and high-risk myelodysplastic syndrome. Cancer 124, 2758–2765 (2018).
6.Fischer ES, Bohm K, Lydeard JR, Yang H, Stadler MB, Cavadini S, et al.Structure of the DDB1-CRBN E3 ubiquitin ligase in complex with thalidomide. Nature 2014;512:49–53.
7.Cardote TAF, Gadd MS, Ciulli A. Crystal structure of the Cul2-Rbx1-EloBCVHL ubiquitin ligase complex. Structure 2017;25:901–11.
版权声明
欢迎个人评论分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置见“转自:佰傲谷”。
