1. 概述
溶瘤病毒(Oncolyticvirus,OVs)是一类很有前景的新型肿瘤治疗药物,其作用机制主要有两种:A. 选择性在肿瘤细胞中复制杀死肿瘤细胞;B. 释放肿瘤抗原启动机体强大的抗肿瘤免疫。有趣的是,无论是肿瘤细胞还是宿主细胞(如免疫细胞)内的能量代谢,在OVs介导的抗肿瘤反应中起着关键作用。治疗给药后,OVs必须阻断肿瘤细胞的代谢途径,以获得诸如核苷酸、脂类和氨基酸等物质,以进行复制。此外,OVs刺激的抗肿瘤免疫反应高度依赖于肿瘤微环境中的代谢状态。因此,代谢调控策略有可能提高OVs介导的肿瘤溶解和抗肿瘤免疫反应的有效方法。
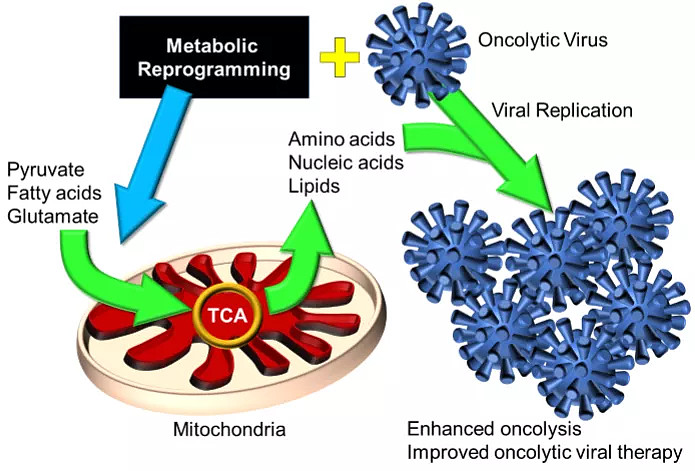
图1 代谢调控与OVs
2. 肿瘤的代谢特征葡萄糖是所有细胞的主要能量来源,正常细胞和肿瘤细胞通过糖酵解生成丙酮酸来消耗和分解葡萄糖,但肿瘤细胞消耗和分解葡萄糖的速率要高得多。在正常细胞中,丙酮酸进入TCA循环,经一系列反应被氧化释放储存能量。相反,肿瘤细胞通过一个被称为“Warburg效应”或有氧糖酵解的过程,将葡萄糖除了被分解成丙酮酸外,还被用作合成大分子的前体。且产生的丙酮酸通常被还原为乳酸。这种代谢主要是由肿瘤细胞诱导的丙酮酸脱氢酶的阻滞所调节的,为了补偿进入TCA循环的葡萄糖流的损失,肿瘤常通过谷氨酰胺代谢来补充TCA循环,以及通过脂肪酸氧化增加进入乙酰辅酶A的代谢流。这种代谢重组建立了一种适合肿瘤细胞增殖的状态。有趣的是,肿瘤细胞对“Warburg效应”的依赖使它们易受某些代谢抑制剂的影响,如使用2-脱氧葡萄糖来增加对己糖激酶抑制的敏感性。到目前为止,这种肿瘤特有的代谢脆弱性是否能够被利用来促进OVs的抗肿瘤作用仍然是一个很大的猜测。
3. 肿瘤代谢和溶瘤病毒
与细胞一样,病毒需要氨基酸、核酸和脂质等大分子来复制。由于大多数病毒本质上并不编码合成这些生物分子所需的酶,它们常常劫持宿主细胞代谢途径以满足复制的需要。下面我们将描述OVs与特定的肿瘤代谢途径之间的关系。此外,我们还将讨论如何通过药理学或遗传学手段进行代谢调控来改变OVs的抗肿瘤作用。
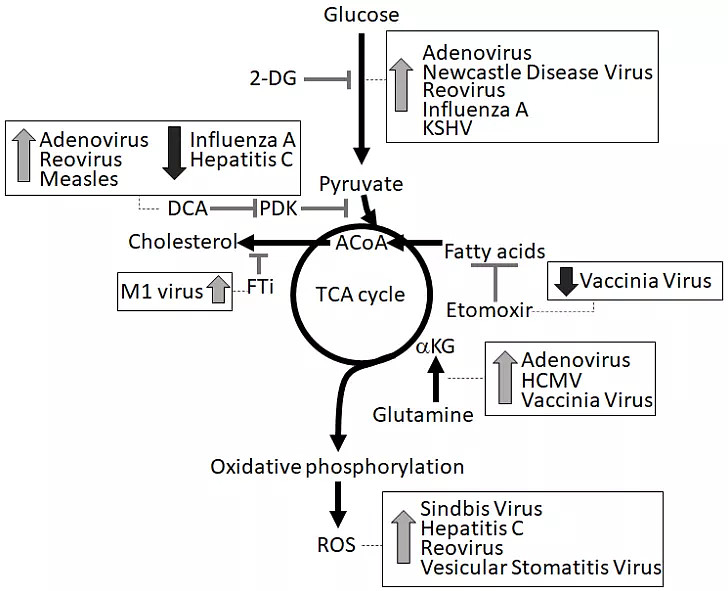
图2 增强溶瘤效应的代谢调控机制
3.1 糖酵解
正常细胞和癌细胞中的病毒感染通常引发葡萄糖摄取和糖酵解的上调。例如,Mayaro病毒和溶瘤HSV-1激活磷酸果糖激酶1(PFK-1),溶瘤人巨细胞病毒(HCMV)和1型人类免疫缺陷病毒增加葡萄糖转运体表达,丙型肝炎病毒增强己糖激酶活性。尽管这些病毒导致糖酵解增加,但用2-脱氧葡萄糖等糖酵解抑制剂可增强许多病毒的溶瘤作用,包括腺病毒、新城疫病毒及呼肠孤病毒。有趣的是,I型干扰素的抗病毒需要糖酵解(目前该机制尚不清楚)。这些发现提示感染诱导糖酵解上调是一种抗病毒机制。这些研究表明阻断糖酵解可以增加肿瘤细胞对OVs的易感性。3.2 丙酮酸代谢PDH催化丙酮酸氧化促进TCA循环,PDH磷酸化抑制是肿瘤中常见的现象,有助于乳酸的产生。然而包括痘苗病毒、丙型肝炎病毒、甲型H1N1流感病毒和呼肠病毒在内的几种OVs通过PDH激酶(PDKs)的表达来抑制PDH活性。与糖酵解增加类似,抑制PDH似乎是抗病毒作用,因为通过DCA诱导的PDKs抑制导致腺病毒、麻疹和呼肠孤病毒的增强溶瘤作用。3.3TCA循环TCA循环为氨基酸、核酸和脂质的细胞合成代谢提供支持。病毒已经进化到劫持利用细胞合成代谢途径,依靠这些基本的物质进行复制。因此,增加TCA循环流量会产生一种有利于病毒复制的状态。事实上,通过谷氨酰胺羧化作用进入α-酮戊二酸而增加的代谢通量增强了腺病毒和HCMV6的溶瘤特性。类似地,用Etomoxir或Trimetazidine抑制脂肪酸β氧化和进入TCA循环可减少痘苗的复制。值得注意的是,RIG-I-MDA5-MAVS复合物是一种直接与线粒体膜结合的主要抗病毒防御系统,其活性通过增加TCA循环的代谢通量而受到抑制,从而形成有利于病毒复制的环境,进入TCA循环的通量增强有利于OV复制和溶瘤。3.4 氧化磷酸化氧化磷酸化是线粒体中电子从还原的NADH或FADH2转移到氧而产生ATP的过程,与几种病毒的感染和复制有关。例如,溶瘤HCMV和Sindbis病毒需要增加氧化磷酸化,而抑制或减少氧化磷酸化则抑制KSHV及疱疹病毒的复制。此外,活性氧(ROS)是氧化磷酸化的副产物,在病毒复制和溶瘤中也起作用。ROS增强了呼肠孤病毒、Sindbis病毒和丙型肝炎病毒诱导的细胞毒性。此外,ROS激活转录因子NRF并增强了水泡性口炎病毒的溶瘤作用。这些发现表明,氧化磷酸化和ROS增强了OVs的溶瘤作用。
4. 肿瘤和OVs治疗中的免疫代谢
除了OVs直接介导肿瘤溶解外,OVs的另一个功效是诱导有效的抗肿瘤免疫反应。在免疫抑的TME中,抗肿瘤免疫反应的每个成分都有一个独特的代谢要求(如图3所示)。具体来说,CD8+T细胞需要大量的糖酵解流及ROS。另一方面,CD8+记忆性T细胞依赖于线粒体的高代谢通量(最显著的来自脂肪酸氧化)。因此,CD8+T细胞功能可以通过代谢调控来改变。此外,CD4+T辅助细胞优先使用糖酵解而不是氧化磷酸化,而免疫抑制性CD4+Foxp3+调节性T细胞(Tregs)则使用氧化磷酸化而不是糖酵解。事实上,通过DCA抑制PDK迫使代谢通量进入线粒体,推动Tregs的形成。TCA循环的中断(异柠檬酸脱氢酶和琥珀酸脱氢酶),导致炎症基因表达。相反,抗炎M2巨噬细胞依赖于TCA循环。通过谷氨酰胺酶1抑制剂BPTES63抑制谷氨酰胺分解,模拟TCA循环的中断,可以促进M1巨噬细胞的分化。这些都显示了代谢调控策略对免疫细胞的影响。
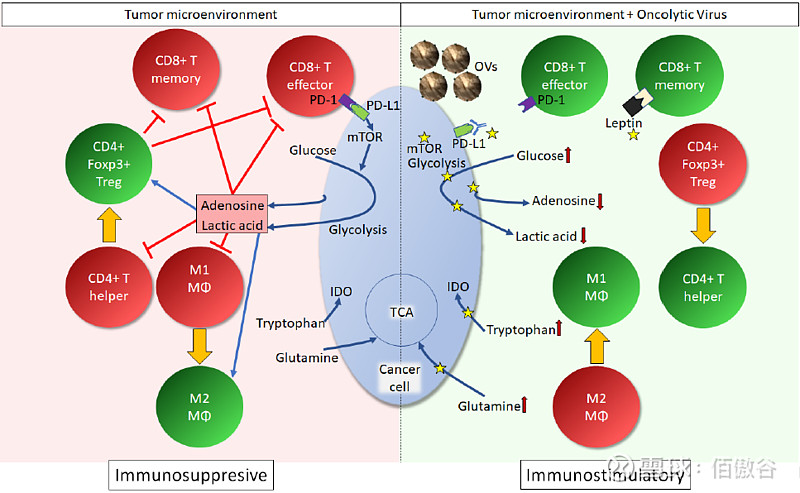
图3 潜在增强OVs抗肿瘤免疫反应的代谢靶点
TME不利于抗肿瘤免疫反应的启动和维持,有助于肿瘤细胞的免疫逃逸。肿瘤细胞在葡萄糖、色氨酸和谷氨酰胺等必需代谢物的竞争中超过免疫细胞,并产生免疫抑制代谢物,包括乳酸(通过有氧糖酵解)、酪氨酸和腺苷(通过CD73/CD39/CD38介导的细胞外ATP/NAD+分解)。TME中的这种代谢异常建立了免疫抑制环境,促进CD8+T细胞衰竭和Treg发育。此外,免疫检查点(即PD-L1/PD-1)通过mTOR信号进一步促进肿瘤中的Warburg效应,扩大了肿瘤和免疫细胞之间的代谢差异。
小编总结
肿瘤细胞的代谢调控可用来增强抗肿瘤免疫反应。例如,利用糖酵解基因敲除或免疫检查点抑制剂抑制肿瘤细胞糖酵解以降低乳酸生成,促进抗肿瘤CD8+T效应细胞应答。Rivadeneira等人最近的一项研究结果表明,工程化的溶瘤痘苗病毒在肿瘤细胞中表达脂肪因子leptin,可增强CD8+T细胞的抗肿瘤反应。在这里,OVs表达的leptin通过刺激线粒体诱导记忆CD8+T细胞。有了这种适应代谢调节基因的能力,OVs可以被用于纠正被抑制的代谢环境,刺激抗肿瘤免疫反应。靶向代谢调控可用于改善OVs诱导的肿瘤溶解和抗肿瘤免疫,从而可用于制定有效的基于OVs的肿瘤症治疗方案。
参 考 文 献
[1] Rivadeneira, DB, DePeaux, K, Wang, Y, et al. (2019). Oncolytic Viruses Engineered to Enforce Leptin Expression Reprogram Tumor-Infiltrating T Cell Metabolism and Promote Tumor Clearance. Immunity 51: 548-560 e544.[2] Leone, RD, and Emens, LA (2018). Targeting adenosine for cancer immunotherapy. Journal for immunotherapy of cancer 6: 57.[3] Yin, Z, Bai, L, Li, W, Zeng, T, Tian, H, and Cui, J (2019). Targeting T cell metabolism in the tumor microenvironment: an anti-cancer therapeutic strategy. Journal of experimental & clinical cancer research : CR 38: 403.[4] Rhim,J H, Tosato G(2007).Targeting the Tumor Vasculature to Improve the Efficacy of Oncolytic Virus Therapy. Journal of the National Cancer Institute(23):23.[5] Sukumar, M, Liu, J, Ji, Y, Subramanian, M, Crompton, JG, Yu, Z, et al. (2013). Inhibiting lycolytic metabolism enhances CD8+ T cell memory and antitumor function. The Journal of clinical investigation 123: 4479-4488
更多精彩请关注微信公众号“佰傲谷BioValley”和“生物制药小编”。