(一)PFS和OS双主要终点,可能导致3期临床失败
首先需要说明,
关键注册临床试验中,PFS为主要终点之一,可能导致另一个主要终点OS的α值被分配,进一步可能导致3期临床试验失败。
参考默沙东K药的keynote604研究,就是如此。
OS P值=0.0164,P值<0.05,可是未达到预设的<0.0128,OS数据却宣布#失败# 。
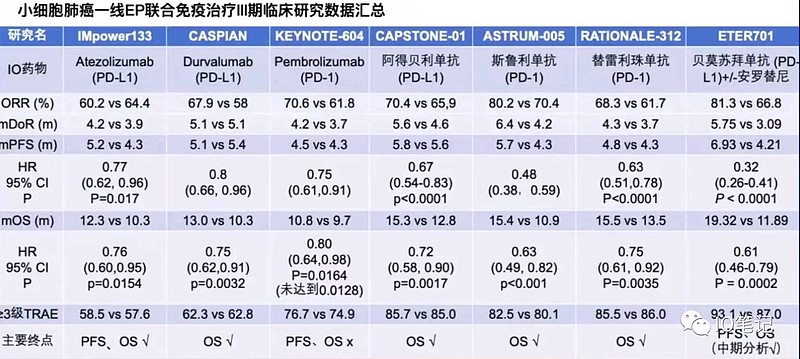
(二)君实生物PD-1单抗一线治疗广泛期小细胞肺癌的3期临床,采用了PFS和OS双主要终点
除了罗氏PD-L1单抗(T药),$君实生物-U(SH688180)$ PD-1与其他广泛期小细胞肺癌免疫治疗研究设计不同的是,该研究采用了PFS、OS#双主要终点# 。
虽然OS是临床研究的金标准,是临床医生和患者最关注的终点,也是药监机构非常认可的终点。实际上PFS也具有非常重要的临床意义,能够评价治疗方案能否延缓肿瘤进展、提高患者生活质量。
3期临床采用OS和PFS双终点的设计,在统计学上的要求更高。其中两个关键要求是:在不同研究终点之间合理分配α值;针对每个研究终点计算样本量,确保有足够的统计学效能来下确证性结论。
对于3期临床研究,特别是确证性的注册关键研究,整体α值只有0.05。如果采用双终点的话,则意味着每个终点初始分配的α值会更小,因此每个终点成功的难度相比单终点更大。
例如,3期关键注册临床试验的双终点设计需要符合上述要求,一般来说研究首先将整体的0.05的α在OS和PFS之间进行了分割,OS和PFS初始分别分得0.045和0.005,并且采用了α回收策略。同时从样本量方面考虑,针对OS和PFS终点,3期临床数据都有足够的统计学效能下确证性的结论。在这样情况下得到的PFS结果的阳性结论无疑是更加可信的。
也正因如此,双终点如果能够同时达到,那么其临床意义可能会更加重要。
而且,从统计学角度来讲,只有参与了α值分配并计算样本量的研究终点,才能够给出确证性结论,用来支持适应证获批,没有参与α控制的研究终点不能用于支持《欧洲药品说明书》声称的获益。
(三)其他药企PD-1的临床试验设计,只有OS一个主要终点。
反而是,
$复宏汉霖(02696)$ PD-1,只有OS一个主要终点数据。(按照欧洲药品说明书要求,没有统计学设计,PFS数据显著疗效,不能写进药品说明书)。
恒瑞医药PD-L1,也只有OS一个主要终点数据。
$百济神州-U(SH688235)$ PD-1,也只有OS一个主要终点数据。
综上所述
君实生物临床试验设计能力更强,统计学设计更高明。
其他PD-1仅仅是模仿海外的3期临床试验设计而已。