瑞德西韦是$吉利德科学(GILD)$ 开发的针对RdRp靶点的小分子注射药物。
VV116是$君实生物-U(SH688180)$ 开发的针对RdRp靶点的小分子口服药物。
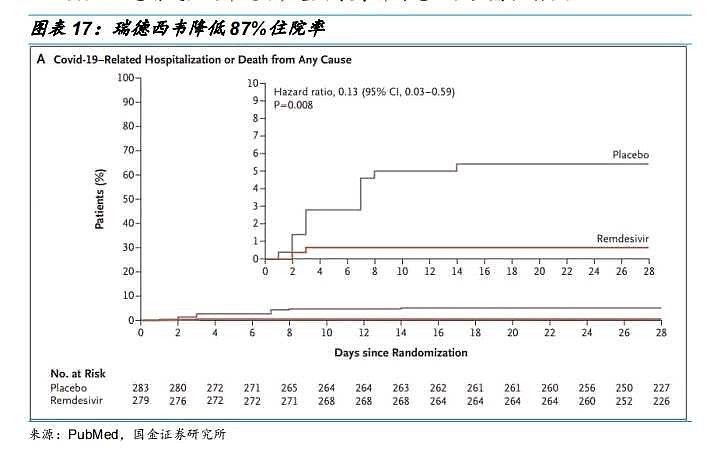
2020年9月至2021年4月,吉利德科兴针对瑞德西韦治疗轻中度、高风险新冠患者开展了PINETREE试验。
这是一项随机、双盲、安慰剂对照的III期临床,一共纳入了584名轻中度、高疾病进展风险的新冠患者。试验结果显示,瑞德西韦治疗组的住院率为0.7%(2/279),而对照组的住院率为5.3%(15/283),即瑞德西韦降低了87%的住院率。安全性数据显示,与治疗方案相关的不良反应发生率为瑞德西韦组12.2%,安慰剂组8.8%;5%以上患者发生的常见不严重不良事件为恶心、头痛和咳嗽。
基于这项临床数据,2022年1月22日,美国🇺🇸FDA在原有的重症适应症基础上扩大了瑞德西韦的适应症,美国🇺🇸FDA批准其用于治疗病情有高风险进展为严重COVID-19(包括住院或死亡)的非住院成人和青少年患者。
2022年4月25日,美国🇺🇸FDA再次扩大了瑞德西韦的批准范围,新增可用于年龄28天及以上、体重至少3公斤、新冠病毒检测结果呈阳性、轻中度且有高风险发展为住院或死亡的儿童患者。瑞德西韦是首个获批用于12岁及以下儿童的新冠治疗药物。这项批准是基于瑞德西韦已完成的针对成人3期临床,及一项针对儿童的单臂、开放性、2/3期临床,这项儿童2/3期临床纳入了53名儿童患者,研究显示安全性和药代动力学与成人类似。
需要注意,
真实生物/$复星医药(SH600196)$ 阿兹夫定,仅仅是中国🇨🇳NMPA附条件批准了,新冠普通型成年人适应症。
由于奥密克戎诊断为普通型比例只有4%,这个适应症太小了。
