$君实生物-U(SH688180)$ PD-1肝细胞癌术后辅助治疗适应症,依据中国3期临床数据向美国FDA提交注册的理由。
(一)孤儿病
美国🇺🇸FDA认定肝细胞癌是孤儿病。孤儿药可以依据中国🇨🇳3期临床试验数据,向FDA提交注册申请。
(二)肝细胞癌术后辅助治疗,是未满足的临床需求
目前为止,在治疗性肝切除手术或消融术后的辅助治疗中,还没有一种全身治疗被证明是有益的。STORM研究证明索拉非尼术后辅助治疗无效。
索拉非尼应用于肝细胞癌根治术后辅助治疗的全球多中心3期临床研究(STORM研究)并未达到预期的效果。
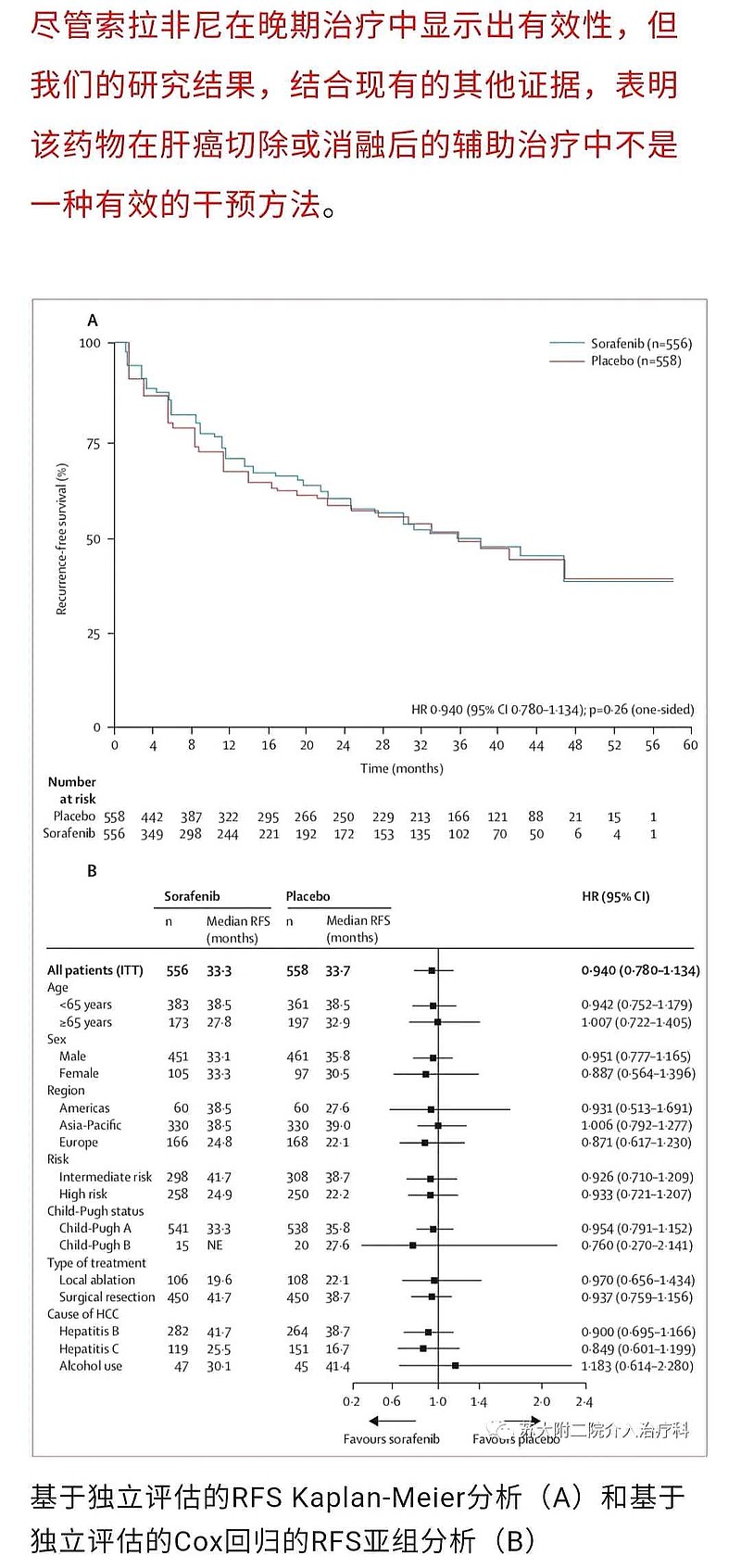
该研究是目前为止,肝癌辅助治疗领域样本量最大的前瞻性随机对照研究,共入组1114例性肝细胞癌根治性切除手术后患者,随机分入索拉非尼组(556例)及安慰剂对照组(558例),结果显示两组患者的中位PFS及OS无统计学差异。提示根治术后应用索拉非尼辅助治疗并不能降低复发率及提高总生存。
(三)K药肝细胞癌术后辅助治疗,预计2025年达到临床试验终点
#默沙东# K药已经获得美国🇺🇸FDA批准了三项辅助治疗适应症。
①黑色素瘤辅助治疗,
②三阴乳腺癌新辅助/辅助治疗,
③肾癌辅助治疗。
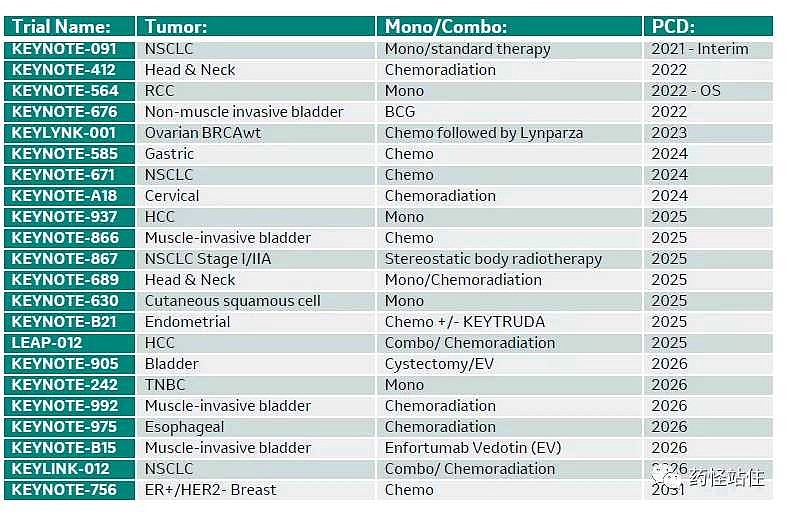
默沙东K药肝细胞癌术后辅助治疗有二项3期临床试验:keynote937研究(NCT03867084)、LEAP012研究。
预计2025年达到临床试验终点。
(四)O药肝细胞癌术后辅助治疗,预计2023年达到临床试验终点
CheckMate 209-9DX研究,2018年启动,正在测试百时美施贵宝O药单药的肝细胞癌术后辅助治疗(NCT03383458)。计划在全球20个国家招募530例接受过根治性切除或消融治疗后仍有较高复发风险的早期HCC患者。
根据2020年JPM大会,预计2023年达到临床试验终点。
(五)君实生物特瑞普利单抗肝细胞癌术后辅助治疗,预计2022年达到临床试验终点
君实生物做到了#全球临床试验进度第一# 。
君实生物从2018年12月起,就开展了肝细胞癌PD-1(特瑞普利单抗)单药手术后辅助治疗的中国3期临床,已经于2021年6月完成入组,预计于2022年读出数据。3期临床主要终点是无疾病复发生存时间(RFS),次要终点是总生存期OS,12个月OS率,24 个月OS率。
计划向美国🇺🇸FDA提交注册申请。
(六)默沙东K药肝细胞癌二线治疗,也打算用中国3期临床数据,向FDA提交注册
2021 年 9 月,默沙东宣布 3 期临床 keynote394研究达到主要终点,显著延长了亚洲患者 OS。默沙东公布了相应数据,并表示正基于keynote394研究的结果与全球监管机构进行讨论,在美国🇺🇸将其作为一项潜在的验证性研究进行评估。
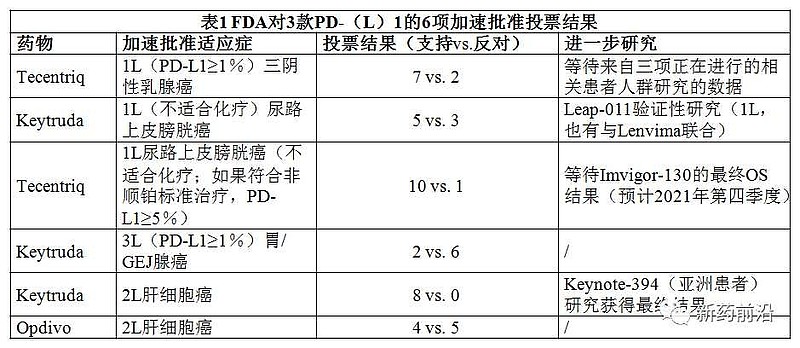
keynote394研究(NCT03062358)是一项随机、双盲 3 期临床试验,评估 K药 + 最佳支持治疗(BSC)与安慰剂 + BSC 在先前接受过索拉非尼或奥沙利铂化疗的亚洲晚期 HCC 患者中的疗效。主要终点是 OS,其他终点包括 PFS、ORR 和 DOR。该研究在中国🇨🇳和韩国🇰🇷招募了 453 名患者,由中国🇨🇳秦叔逵教授牵头开展。
总结
君实生物特瑞普利单抗肝细胞癌术后辅助治疗3期临床试验,孤儿药,全球进度第一,提供未满足的临床需求。
很有可能依据中国🇨🇳3期临床数据,向美国🇺🇸FDA提交注册申请,成功获批。
转发,$恒瑞医药(SH600276)$ ,$信达生物(01801)$