$艾吉纳斯(AGEN)$ (Agenus)股价,今晚开盘最大跌幅-32%,原因就在于——2021年10月22日,Agenus宣布自愿撤回PD-1单抗(Balstilimab)的美国🇺🇸上市申请。
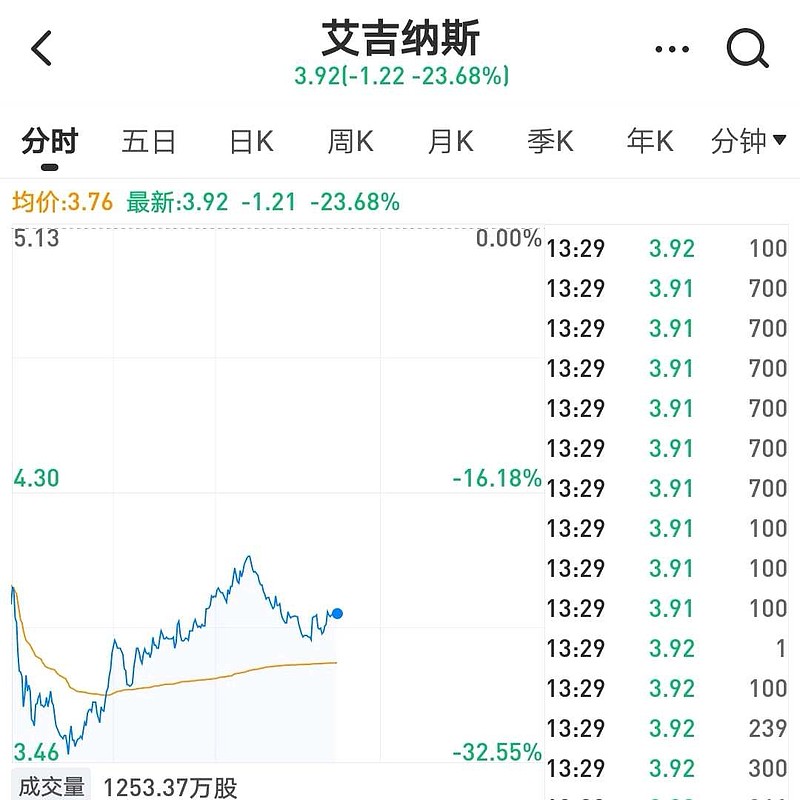
Agenus的PD-1单抗本来应该在2021年12月16日前获得FDA优先审评注册上市的。
此前,美国🇺🇸FDA刚刚(依据KEYNOTE-826的3期临床研究+KEYNOTE-158队列E的2期临床研究)完全批准默沙东K药二线治疗PD-L1阳性宫颈癌,ORR为14.3%。
相同适应症之下,Agenus的Balstilimab单臂试验2期临床,招募入组了160例患者,ORR为20%,FDA认为审评其加速批准已经不合适,建议Agenus撤回上市申请。
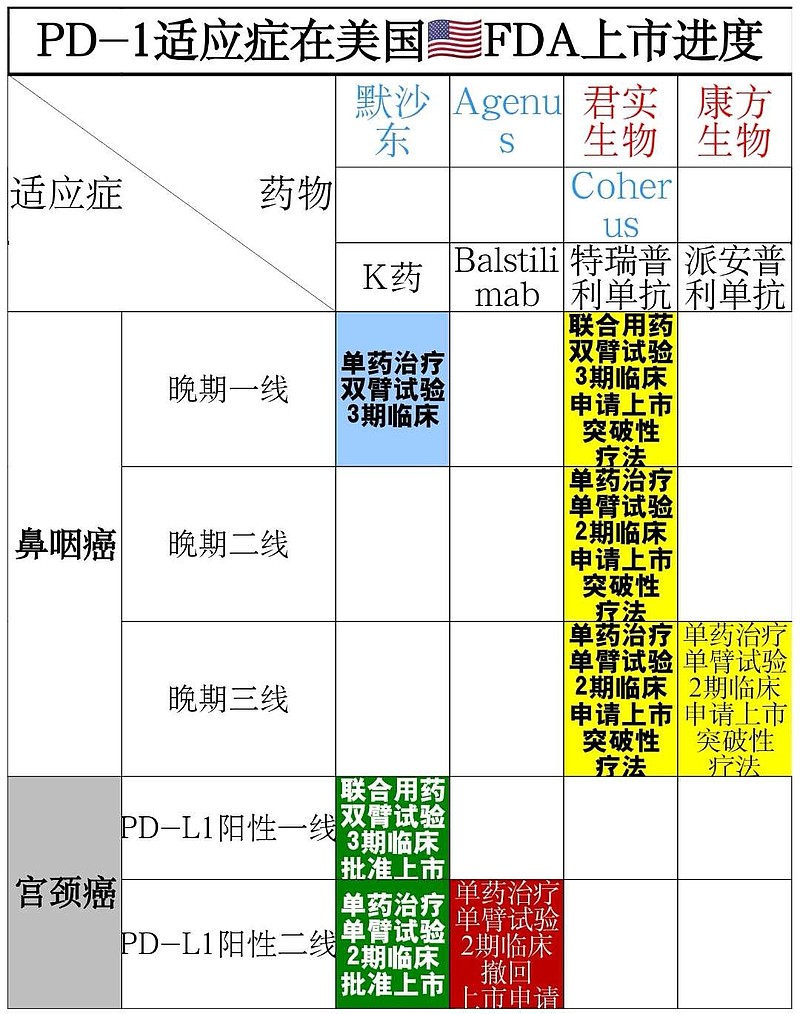
这就意味着,有了双臂双盲3期临床试验的确证数据,FDA可以完全批准$君实生物-U(SH688180)$ PD-1,一线/二线/三线治疗晚期鼻咽癌。
美国🇺🇸FDA几乎100%不会加速批准——$康方生物-B(09926)$ PD-1,三线治疗晚期鼻咽癌,单臂试验2期临床(失去了未满足的临床需求价值)。
需要康方生物补充——双臂双盲3期临床数据。在FDA面前,投机取巧是不行的。
#避免只看整体人群ORR# ,有效率ORR高低与PD-L1表达水平高低相关。
康方生物-B(09926)PD-L1表达水平≥50%入组比例太高了,所以整体人群ORR数据就像是——作弊。
康方生物PD-L1表达水平≥50%亚组,ORR=39.50%。
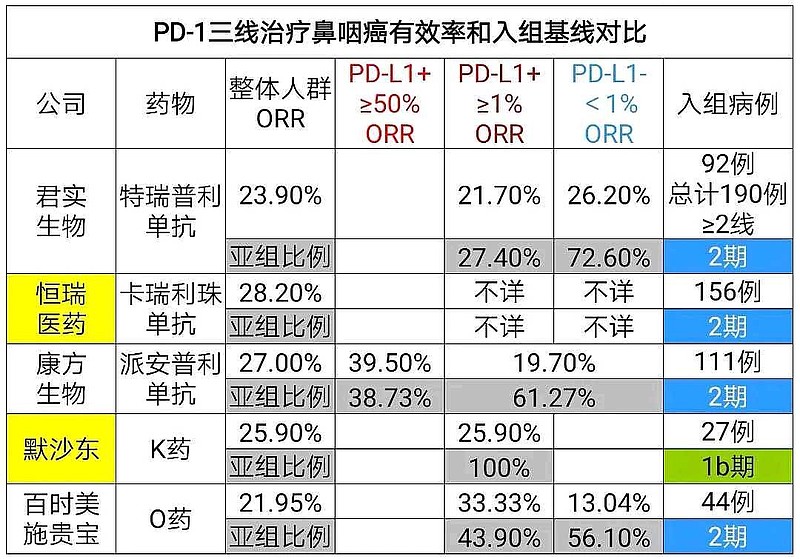
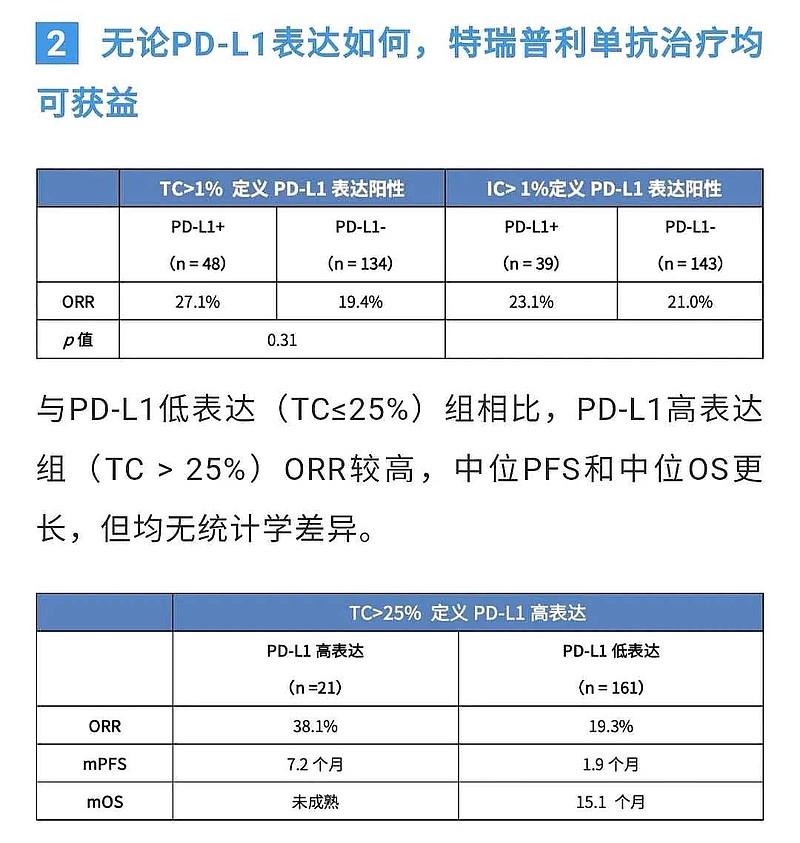
君实生物PD-L1表达水平≥25%亚组,ORR=38.10%。
这个PD-L1低表达水平(<1%)亚组,134人的ORR数据=19.4%,也比较令药监机构信服。
即使最后美国🇺🇸FDA放松——康方生物PD-1审评上市条件。可能的鼻咽癌后线治疗审评结果就是,
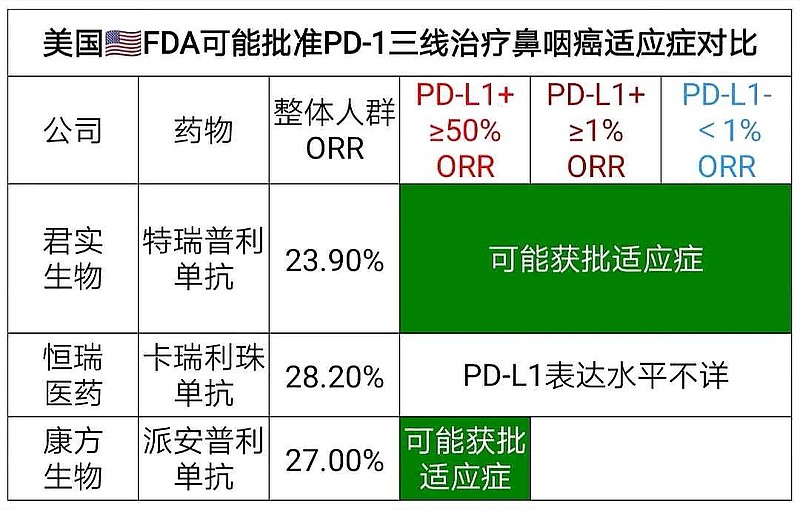
君实生物PD-1,获美国🇺🇸FDA批准,≥2线治疗鼻咽癌,无论PD-L1表达水平,#获批适应症更广# 。
康方生物PD-1,获美国🇺🇸FDA批准,≥3线治疗鼻咽癌,仅仅获批PD-L1表达水平≥50%亚组,获批适应症更窄。