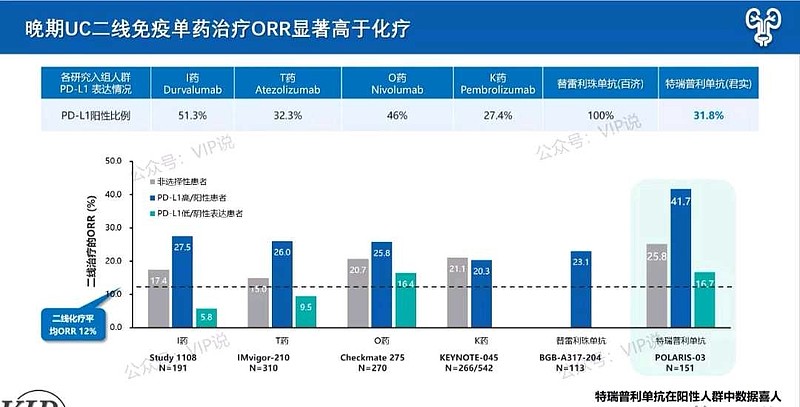
(一)PD-1单药二线有效率低
目前为止,PD-1/PD-L1对于尿路上皮癌的一线治疗和二线治疗有效率太低,ORR只有20+%。但是,$君实生物-U(SH688180)$ 特瑞普利单抗(PD-1)除外,PD-L1+表达的尿路上皮癌≥2线治疗,ORR=41.7%。
(二)目前为止,美国🇺🇸急需对于尿路上皮癌有效率更高的药物。
(1)$荣昌生物-B(09995)$ RC48(HER2-ADC),≥3线治疗HER2+尿路上皮癌,确认客观缓解率(cORR)达到51.2%。获得美国🇺🇸FDA‘‘突破性疗法认定’’。总计才43例2期临床证据。(RC48已经被Seagen西雅图基因26亿美元买走欧美曰发达国家的商业开发权益)
(2)$Seagen(SGEN)$ 西雅图基因Padcev(Nectin4-ADC)+默沙东K药无铂联合用药,一线治疗尿路上皮癌,确认客观缓解率(cORR)高达73.3% 。获得美国🇺🇸FDA‘‘突破性疗法认定’’。总计才45例1a临床证据。
(三)美国🇺🇸晚期尿路上皮癌的一线、二线、三线治疗药物和有效率对比。
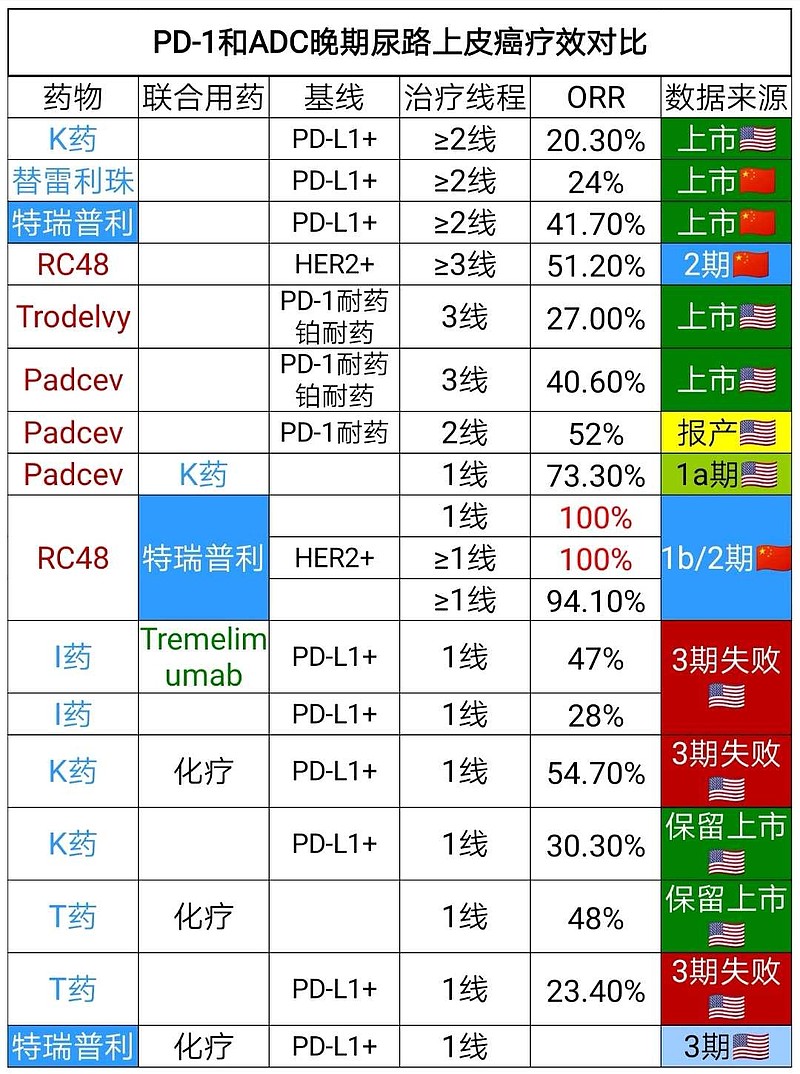
③三线治疗药物是,Trodelvy(Trop2-ADC)、Padcev(Nectin4-ADC)。
FDA已经批准荣昌生物开展RC48三线治疗的关键注册2期临床试验。
②二线治疗药物是,K药、O药、Padcev。
①一线治疗药物是,铂类化疗、K药单药、T药联合化疗的3期临床试验数据不佳,被美国🇺🇸FDA保留适应症。
FDA限定适应症,K药单药,用于不符合顺铂治疗条件PD-L1表达水平CPS≥10或者铂类不耐受,晚期尿路上皮癌一线治疗。
FDA限定适应症,T药+化疗,用于不符合顺铂治疗条件PD-L1表达水平IC≥5%或者铂类不耐受,晚期尿路上皮癌一线治疗。
#君实生物# 已经获得FDA批准开展#国际多中心# 3期临床试验,特瑞普利单抗+化疗,一线治疗PD-L1+晚期尿路上皮癌。
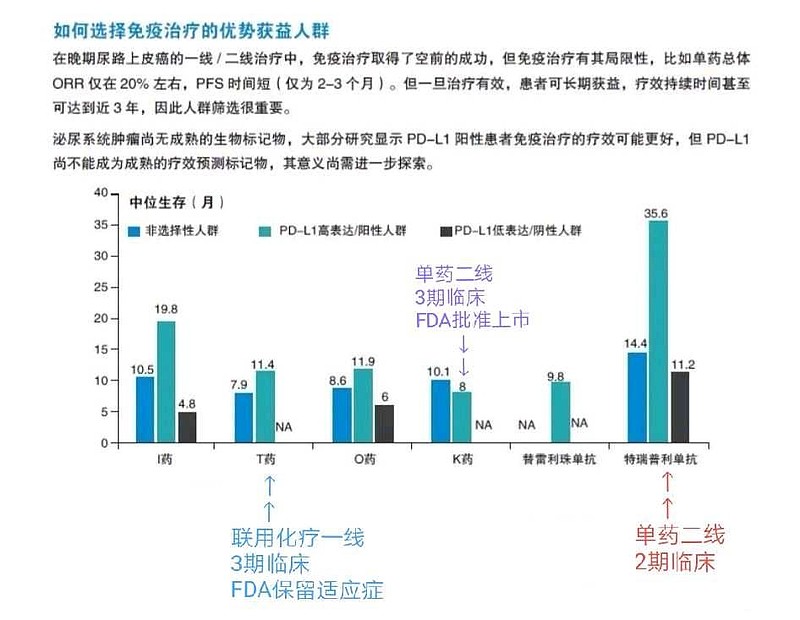
由于特瑞普利单抗的尿路上皮癌二线治疗生存期OS=35.6个月数据太漂亮,特瑞普利单抗联合化疗一线治疗3期临床,可能再次获得美国FDA突破性疗法认定。
(四)美国🇺🇸每年新增22.2万肺癌病例,每年新增9.5万例黑色素瘤,每年新增8.1万例尿路上皮癌病例。
所以,尿路上皮癌其实是一个‘‘PD-1未挖掘的富矿’’。
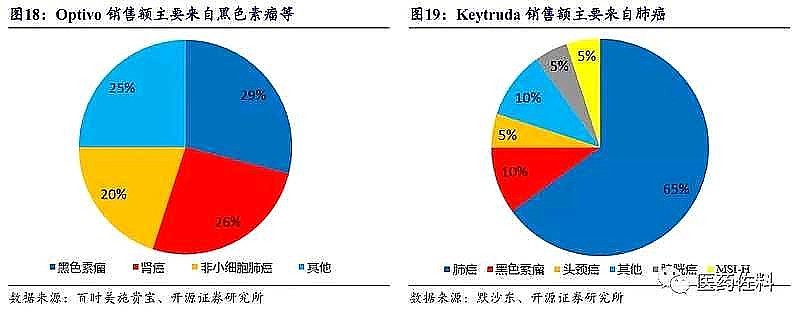
表面上,默沙东K药65%销售额来源于肺癌,只有5%销售额来源于尿路上皮癌。
真相是,非小细胞肺癌PD-1响应率70%,而尿路上皮癌PD-1响应率只有20%。
尿路上皮癌分为三期,①早期非肌层浸润性膀胱癌NMIBC比例高达75%-80%,②中期肌层浸润性膀胱癌MIBC,③晚期尿路上皮癌mUC比例不够多。
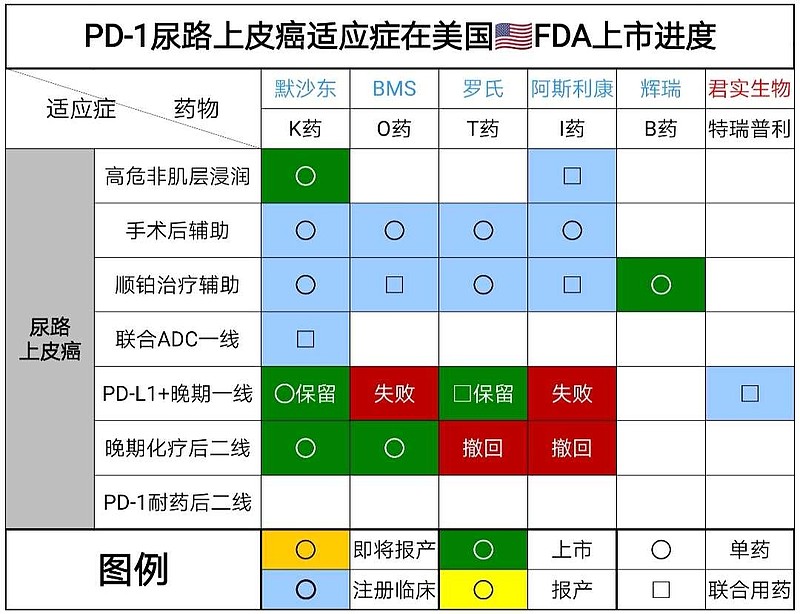
所以,尿路上皮癌的PD-1市场开发策略是,从晚期三线治疗→晚期二线治疗晚期→晚期一线治疗→顺铂后辅助治疗→肌层浸润手术后辅助治疗→卡介苗治疗失败/高危非肌层浸润
尿路上皮癌成为了被资本市场忽视的PD-1免疫治疗适应症。