——快 讯——
2023年 AACR大会上,近年来的新兴创新企业—Moderna,公布了其治疗性癌症疫苗mRNA-4157 (V940) 联合pembro治疗黑色素瘤的2期临床结果。虽然Moderna宣布研究结果一如即往的令人期待,然而,在数据公布的第二天,Moderna的股价却应声下跌8.36%。从测方面验证了外界是担忧肿瘤疫苗赛道前景的。本文就已经公布的slides上的结果去分析,为何外界不看好公布的研究结果。从中也可以窥探,投资者并没有只关注研究结果本身,更多在于商业化的考量。



KEYNOTE-942是一项随机、开放标签的IIb期研究,主要终点为无复发生存期(RFS),定义为从第一剂帕博利珠单抗到首次复发(局部、区域或远处转移)、新的原发性黑色素瘤或意向治疗人群中任何原因死亡的时间。次要研究终点是无远处转移生存(DMFS)、安全性和耐受性。
在完全切除后复发风险较高的III/IV期黑色素瘤患者中,mRNA-4157(V940)与帕博利珠单抗联合治疗与单独使用帕博利珠单抗组比较疗效和安全性数据。

107位患者接受mRNA-4157 (V940) 联合pembro治疗,50名患者接受pembro治疗。
患者基线特征如下图所示,两组基线大部分一致,联合组既往接受多次手术的更多。


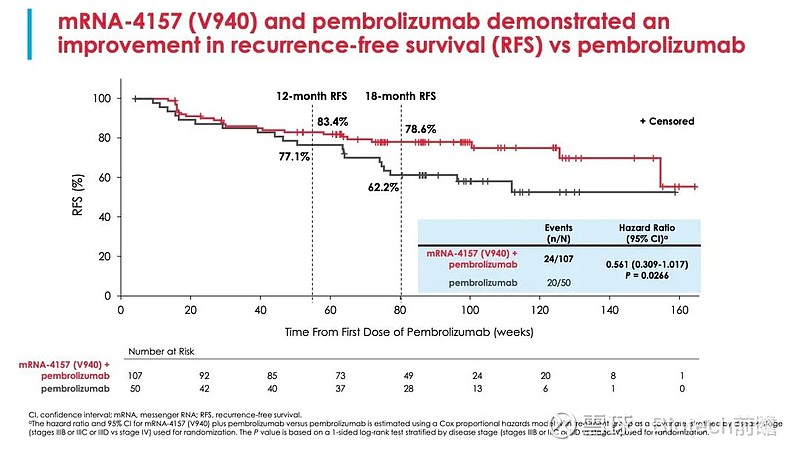
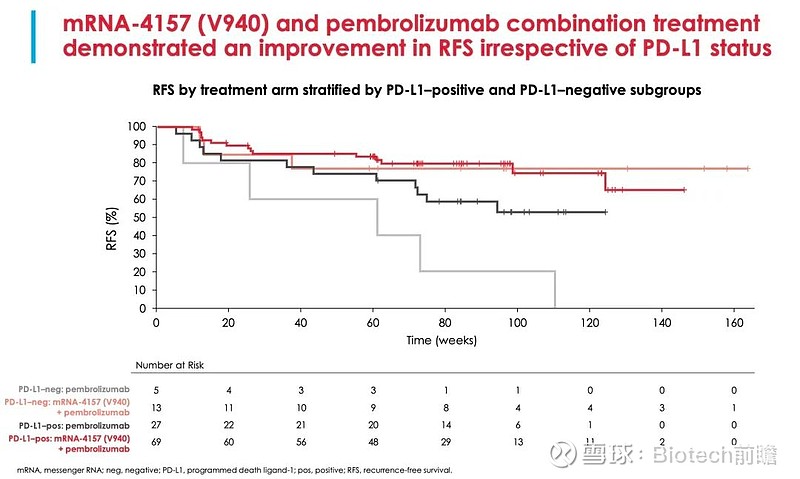
两组的RFS曲线和按照PD-L1分层的RFS曲线如下,联合组和对照组的12个月RFS率(无复发生存时间,病人在经过抗肿瘤治疗后,获得完全缓解时到出现复发或者随访截止的时间)分别为83.4%(95%CI[置信区间],74.7-89.3)和77.1%(95%CI,62.5-86.6);联合治疗组和对照组的18个月RFS率分别为78.6%(95%CI,69.0-85.6)和62.2%(95%CI,46.9-74.3)。

研究结论
在完全切除后复发风险较高的黑色素瘤患者中,mRNA-4157(V940)和pembro在RFS方面的临床显著改善,与标准治疗pembro单药相比,经过2年的随访,复发或死亡的风险降低了44%;
与单独使用pembrolizumab相比,mRNA-4157(V940)与pembro联合使用耐受性良好,没有增加3-4级irAE或严重AE
mRNA-4157(V940)与pembrolizumab联合用药于2023年2月获得FDA的突破性治疗指定,并于2021年4月获得欧洲药品管理局的PRIME指定
隐忧
黑色素瘤本身就是免疫获益型癌症,在ICBs治疗时代,也促进了多款ICBs的成功上市,包括LAG3抗体,而对于癌症的治愈的追求,是人类矢志不渝的责任和使命。在新冠疫情影响下,加速了mRNA疫苗的研发进程。对于肿瘤相关mRNA的研发,也是Biotech和MNC企业合作的重中之重。默沙东作为疫苗起家的MNC,借助于帕博利珠单抗迅速成长为肿瘤治疗领域的MNC,帕博利珠单抗已经取代阿达木单抗,成为新的全球“药王”,逐步进入到产品衰退期。如何有效延长产品的生命周期,与其他新型药物进行联合适应症探索,则是当务之急。选择mRNA领域的翘楚Moderna,布局更具想象力的肿瘤疫苗赛道,此次的2b期研究的成功,无疑影响深远。而Moderna与MSD的合作模式,也是当下创新药物研发的一个缩影。但对于已经免疫获益且有诸多产品获批适应症的黑色素瘤领域,研究已经处于高度竞争状态,且市场空间有限。研究本身并未对mRNA-4157 (V940)制作周期及成本有汇报过,这也是严重阻碍肿瘤疫苗研发快速推进的绊脚石。与CAR-T赛道面临的商业化难题一样。但毫无疑问,有更多的企业开始布局肿瘤疫苗赛道。
2022年3月8日,BioNTech宣布扩大与再生元的战略合作,以推进公司的重磅产品BNT116(mRNA疫苗)与Libtayo (西米普利单抗, PD-1单抗) 的联合方案,用于晚期非小细胞肺癌的疗效探索。

上一次两家企业的合作可以追溯到2020年7月31日,BNT111(mRNA疫苗)与Libtayo联合方案用于黑色素瘤的研究探索。此次是进一步扩大合作,布局的还是全球发病率高的非小细胞肺癌领域,足见BioNTech公司对于其研发的mRNA疫苗联用免疫疗法的信心。
由此可见,mRNA肿瘤疫苗联合PD-(L)单抗的研究方案,正在临床中快速推进。
接下来,我们具体看下不同组合方案目前披露的有效性数据和作用机制。
BNT111

来自BioNTech 官网
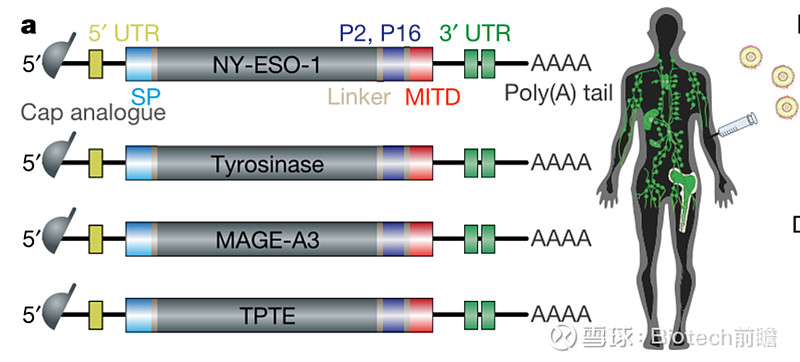
BNT111为BioNTech进度最快的研发管线,适应症为晚期黑色素瘤。BNT111是一款编码NY-ESO-1、Tyrosinase、MAGE-A3、TPTE等4种肿瘤相关抗原(tumor-associated antigen,TAA)的mRNA疫苗,递送载体为脂质体(liposomal,LPX),通过静脉注射的方式输入病人体内。
来自Sahin et al, Nature 2020
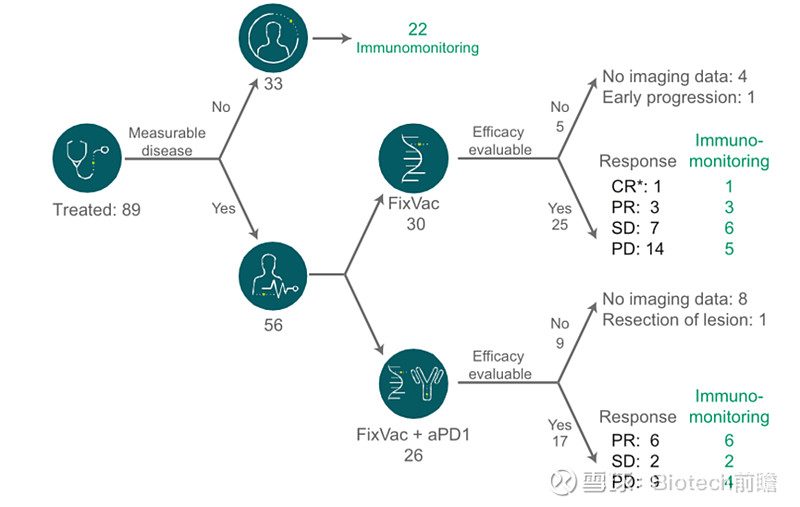
剂量递增1期临床试验(Lipo-MERIT试验,NCT02410733),共入组了56名患者,其中30名患者接受BNT111单独治疗,26名患者接受BNT111与PD-1单抗的联合治疗。
来自Sahin et al, Nature 2020
联合治疗组有6例患者CR,2例SD,9例PD,优于BNT111单药组。另外,数据显示BNT111疫苗安全性良好。最常见的副作用为轻微至中等程度的发热和感到寒冷,但通常在接受治疗后的24小时内即可缓解。
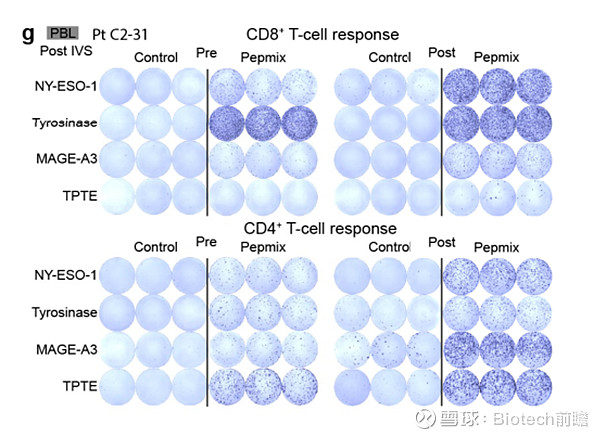
来自Sahin et al, Nature 2020
至于为何联用组疗效要显著优于单药组,研究人员进一步使用了IFN-γ ELISpot技术对患者体内CD4+ T细胞和CD4+ T细胞识别抗原的能力进行了检测。结果显示,患者体内的T细胞在疫苗输注之后至少获得了特异性识别NY-ESO-1、Tyrosinase、MAGE-A3、TPTE其中至少一种抗原的能力。由此,BNT111联用PD-1单抗,能够有效激活免疫细胞。
MEDI1191 (IL-12 mRNA癌症疫苗) 联合Durvalumab的晚期实体瘤I期结果于2021年ESMO TAT(ESMO国际靶向抗癌治疗大会)上进行了公布。

来自2021 ESMO TAT 官网
结果显示,在接受一种或多种标准全身治疗的10例(6例经过免疫治疗)晚期实体瘤患者中,在肿瘤内(IT)注射给药MEDI1191并联用Durvalumab(PD-L1单抗)后,有两例患者出现免疫应答,安全性和耐受性良好,≥3级不良反应没有发生。这种初期结果还是非常令人兴奋的, 特别是在免疫治疗失败的患者上能够再次起效,具体机制是否能解释的通呢?

来自Cancers 2021,13,167
首先还是要从IL-12(白细胞介素-12)说起,IL-12是由抗原提呈细胞和B细胞产生,是一种异源二聚体形式的前炎症细胞因子,并以这种形式分泌到细胞外。IL-12免疫调节方面起着重要的作用,可以通过直接诱导T细胞亚群的发育和改变决定疾病预后的许多细胞群的功能和命运来形成免疫反应。如通过促进M1巨噬细胞极化和Th1细胞产生IFN-γ,激活针对肿瘤细胞的免疫应答,进而刺激产生CD8+T和NK细胞。
来自Cancers 2021,13,167
鉴于此,IL-12可以与其他治疗方式协同,增强治疗效果。已经应用于免疫调节剂、CART技术、化疗和放疗,以及疫苗的研发。
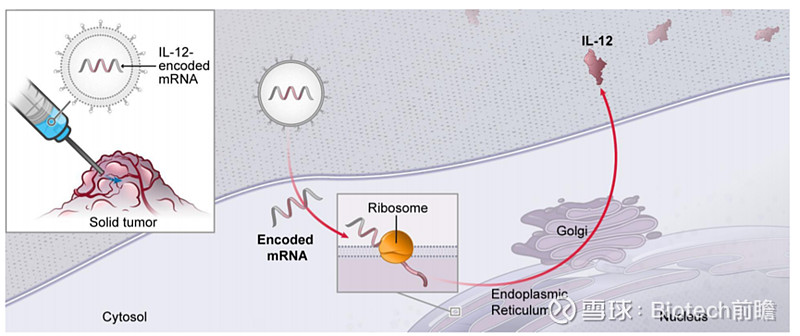
来自Moderna 官网
Moderna的肿瘤疫苗MEDI1191就是基于IL-12,注射进瘤体内,将含有编码抗原蛋白(IL-12)的mRNA注射到瘤体内、mRNA进入细胞、翻译抗原蛋白、抗原蛋白被呈递至细胞表面或被分泌到细胞外引发免疫反应。
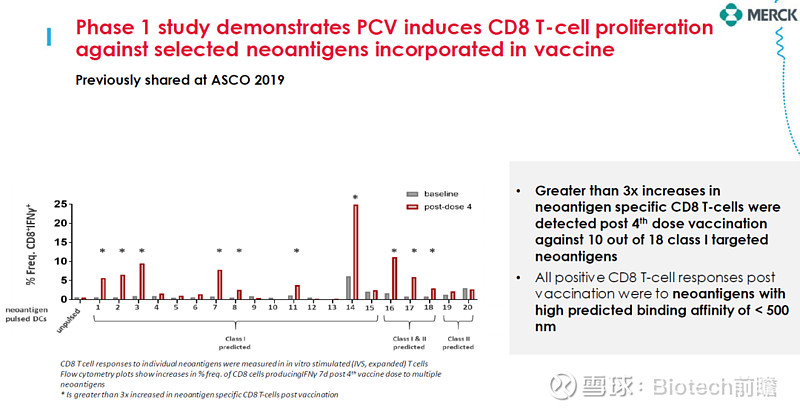
mRNA-4157为一种个性化肿瘤疫苗,靶向患者的特异性突变,编码最多至34种新生抗原。
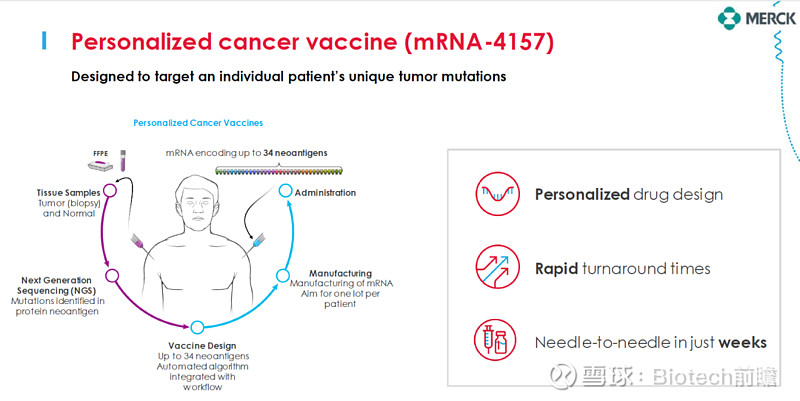
mRNA-4157可以激活肿瘤新生抗原的特异性T细胞,进而杀伤肿瘤细胞。

mRNA-4157在一期临床中证明可以诱导新生抗原特异性CD8 T细胞的增殖。
结语
mRNA肿瘤疫苗与PD-(L)1单抗从机制上能够更加针对肿瘤相关抗原(TAAs),起到协同激活效应T细胞的功效,目前已在临床阶段有初步探索,未来,期冀在更大样本量上带来令人振奋的结果。