前言
诺思兰德精选层唯一一家不盈利的公司,是一家创新型生物制药企业,专业从事基因治疗药物、重组蛋白质类药物和眼科用药的研发、生产及销售,致力于心血管疾病、代谢性疾病、罕见病和眼科疾病等领域生物工程新药的研发和产业化,2020年营收4143.86万,亏损2798.32万。
3月17日公告诺思兰德股权激励预案,与其它上市公司股权激励不同的是,由于诺思兰德尚未实现盈利,不能采用收入、利润等指标作为股权激励的考核指标,所以诺思兰德的股权激励是有史以来第一家没有任何量化业绩作为考核指标的股权激励。
数量与价格
本激励计划拟向激励对象授予权益总计7,820,000份,约占本激励计划公告时公司股本总额254,240,203股的3.08%。激励计划授予的股票期权的行权价格为8.60元/份,限制性股票的授予价格为4.30元/股。
激励对象
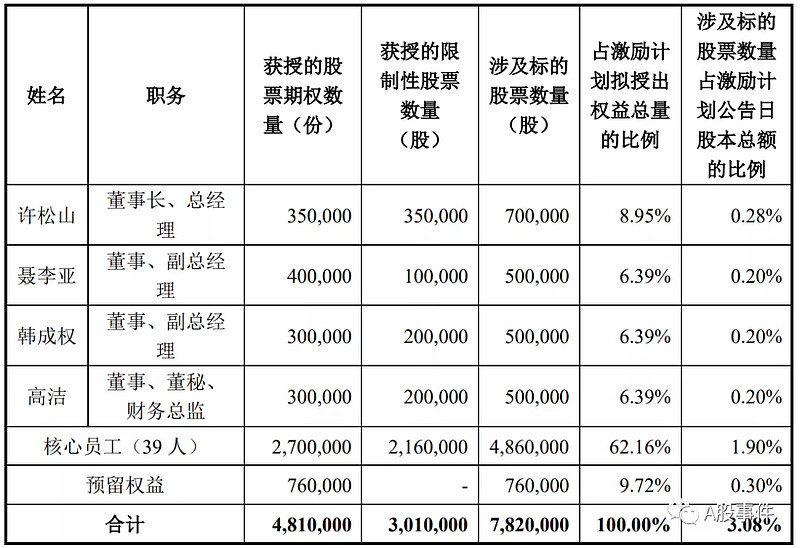
考核指标
本激励计划的行权考核年度为2021-2023年三个会计年度,分三个考核期,每个会计年度考核一次,公司各年度业绩指标如下:

考核指标合理性
本次股权激励公司层面业绩考核指标涵盖了新药研发进度及产业化实施进度,能够直接反映公司现阶段经营成果。
(1)2021年度考核指标:完成NL005项目IIa期临床试验入组NL005是注射用重组人胸腺素β4,属于重组蛋白质药物,用于治疗急性心肌梗死缺血再灌注损伤适应症,该适应症是急性心肌梗死患者微创介入术时常见的心肌进行性加重的病理过程,这种损伤在临床治疗时普遍存在,但目前尚无有效的药品研发成功,是全球范围内的医疗难题。
NL005项目于2015年获得I、II期临床批文;2019年完成I期临床研究;II期临床试验分为IIa期和IIb期,2020年2月IIa期临床伦理会通过,原计划2020年12月底完成IIa期临床试验入组,但由于前期试验方案入选标准的个别规定过于严格,临床试验情况与初期设计预期不符,加之2020年国内疫情持续影响,临床试验进度缓慢。在不额外增加受试者的风险和遵守科学伦理的基础上,公司调整了试验方案,并于2021年3月重新获取所有研究中心伦理批件。虽然公司调整方案后入组速率能够有所提高,但2021年底完成IIa期入组仍有较大压力。
综上,NL005项目在实施过程中因入选标准设定较为严苛,对临床方案进行了调整,加之国内疫情反复,导致实际项目进度与计划存在一定差异。由于患者招募难度及试验质量控制较大,需要充分调动公司研发人员积极性,投入大量人力配合研究中心并管理好服务供应商开展患者招募、克服技术困难做好试验数据的收集与质控等工作,以按计划完成相应研发目标。
(2)2022年度考核指标:NL005项目启动IIb期临床试验并开始入组或完成NL003项目III期临床试验并提交上市申请
NL005项目的IIb期试验能否顺利开展很大程度上取决于IIa期试验的进展速度及试验结果。在完成IIa试验的最后一例受试者入组后,根据试验方案的规定还需要进行3个月的随访,才能完成所有受试者试验数据的收集工作。按照临床试验规范的操作流程,所有受试者完成方案规定的数据收集后,需要开展数据清理、锁库、揭盲、统计分析报告及临床试验总结报告的撰写、研究中心关闭等工作,上述收尾工作通常需要3~4个月的时间。在顺利完成2021年的考核指标的前提下,预计IIa试验的后续工作会延续至2022年上半年。为了使IIb期试验设计符合科学严谨性的同时具备良好的可操作性,需组织各方专家对已获得数据开展充分的分析与论证,通过多轮的专家讨论会形式确定后续试验的设计思路。预计IIb试验的受试者例数及参研中心数等都会有成倍的增长,启动工作难度较IIa期也会有所增加,需开展大量的现场调研,在全国范围内选定出可满足IIb试验技术标准的参研医院。因此,在试验规模放大的同时加大了管理难度的前提下,需要充分调动研发团队及相关部门积极性,竭尽全力加快各中心的立项、伦理过会、协议签署等流程,才能实现2022年NL005项目启动IIb期临床试验并开始入组的目标。
NL003项目是重组人肝细胞生长因子裸质粒注射液,用于严重下肢缺血性疾病(简称:CLI),包括静息痛和缺血性溃疡患者,目前全球仅日本有同类药物有条件获批上市且与公司NL003项目同处于Ⅲ期临床试验阶段,全球范围内尚无通过大样本试验的成功获批案例。该项目于2008年获得I期临床批文;2011年获得II期临床批文;2017年获得Ⅲ期临床批文;2019年3月获得组长单位北京协和医院药物临床试验伦理委员会的批件,2019年7月正式启动Ⅲ期临床试验,目前已启动17家研究单位,原计划于2022年进行上市申请并取得新药证书。2020年国内新冠疫情仍未消除,参与项目临床研究的医院为三甲医院,基于抗疫防控需要,客观上导致造成部分临床试验筛选入组等工作无法正常推进,同时门诊患者数量也大幅减少,部分研究医院暂停临床试验事项,对公司临床试验进度产生较大不利影响。若要完成2022年底提交上市申请的目标,需在2022年3月前完成入组,此后还需至少6个月的随访期及统计报告等文件撰写。此外,提交上市申报是一项系统工程,任何一个节点不能准确的如期完成,都将导致无法如期申报。只有公司各岗位员工细致、努力完成工作,才能保证NL003如期提交上市申请。我们认为该指标的设定综合考虑了客观现实情况,具有一定的挑战性并兼具合理性,能充分调动与激励员工的积极性,保持团队稳定以攻坚克难完成共同目标。
(3)2023年度考核指标:NL003项目获得上市批准或生物工程新药产业化生产车间获得药品生产许可证
据SageGroup分析,2017年我国4,200-6,000万下肢动脉缺血性疾病的患者中,约560-630万人患有严重下肢动脉缺血性疾病。由此推测,2020年我国CLI患者人数可达782万,具有良好的市场潜力。
NL003项目虽受疫情影响较大,但目前国内疫情防控形势已基本稳定,若NL003项目按计划在2023年获批上市,能够有效缓解公司持续亏损的状态。NL003项目生物工程新药产业化是公司重要募投项目之一,该项目规划年产能120万支,预计2023年建成。公司生产车间获得药品生产许可证需要在完成生产厂房经过项目设计、建设审批、工程施工、验收,设施设备安装、验证,GMP体系建立等多个阶段的工作后,才能向监管部门提交申请,需要各个岗位的通力协作。
综上,新药上市和产业化落地之间具有较强的关联性,需要全公司各部门各岗位的员工共同努力完成,采取上述两项指标予以考核具合理性且符合公司战略目标。