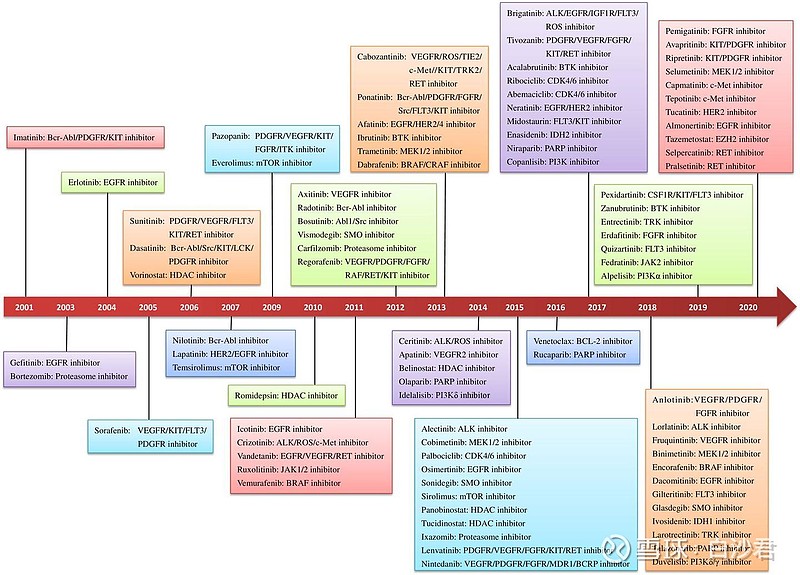
随着现代分子生物学的发展和计算机辅助药物设计、结构生物学、组合化学等先进技术的应用,小分子靶向抗癌药物进入了快速发展阶段。迄今为止,FDA和/或NMPA已批准89种小分子靶向药物用于治疗各种癌症(图1)。数千种靶向药物正在进行癌症治疗的临床试验。其中,大量有希望的药物已进入III期试验。根据商业研究公司的预测,2021年全球抗癌药物市场规模将达到2000亿美元,其中靶向药物是“主力军”。尽管取得了重大进展,小分子靶向抗癌药物仍面临一些挑战。
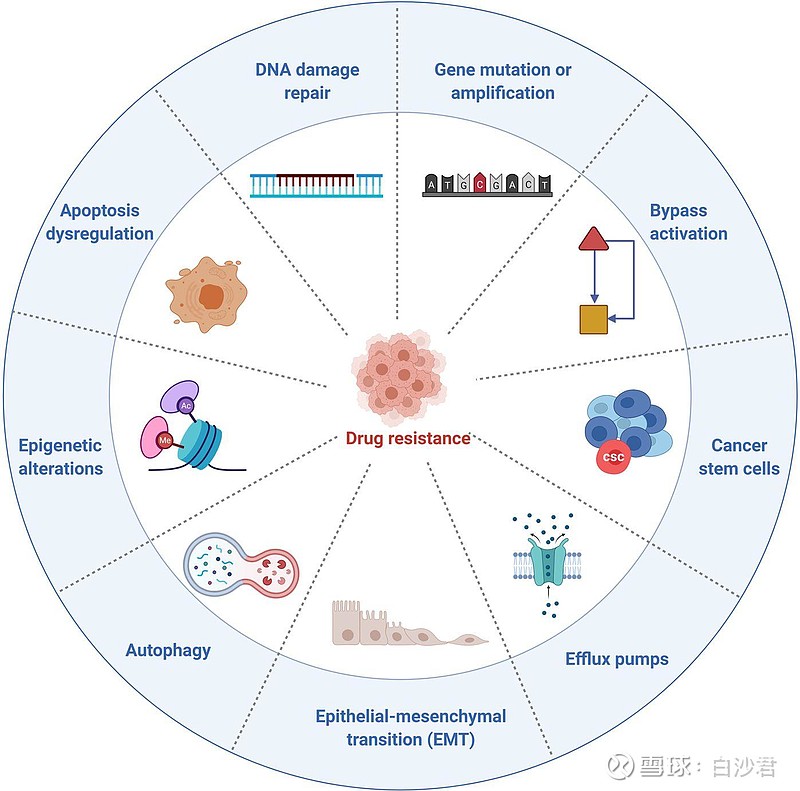
第一个主要挑战是耐药性。几乎所有的靶向抗癌药物在临床使用一段时间后都会遇到耐药性。耐药性与许多机制有关,包括基因突变、扩增、肿瘤干细胞、外排转运蛋白、凋亡失调和自噬等(图2)。基因突变是导致抗肿瘤耐药性的主要原因。关于耐药基因突变有两种不同的观点:一是基因突变是由药物引起的。二是耐药突变已经存在。在治疗的早期阶段,具有药物敏感突变的癌细胞控制并抑制含有耐药突变的细胞的增殖。具有敏感突变的细胞被杀死后,耐药突变细胞成为主流并表现出耐药性。其他基因的扩增是抗肿瘤耐药性的另一个常见原因。例如,MET扩增约占EGFR抑制剂耐药病例的20%。肿瘤干细胞也被认为是耐药和复发的重要原因。肿瘤干细胞理论提出肿瘤内的不同细胞以及由此产生的转移,来源于具有自我更新和分化能力的单个细胞亚群,类似于干细胞。外排转运蛋白(如多药耐药转运蛋白,尤其是P-糖蛋白)的过度表达也在靶向抗肿瘤耐药性中发挥作用。除了这些原因,细胞凋亡失调和自噬也可能与抗肿瘤耐药性有关。
低效率是靶向抗癌药物的另一个主要挑战。正如前面多次提到的,靶向抗癌药物仅对有限数量的患者有效。例如,不到20%的非小细胞肺癌患者对EGFR抑制剂(如吉非替尼和厄洛替尼)敏感。这些EGFR抑制剂敏感的患者被发现存在EGFR阳性突变(例如,外显子19缺失或外显子21 L858R点突变)。TRK抑制剂拉曲替尼和恩曲替尼已被批准用于治疗NTRK基因重排患者,且不用受制于癌症类型和患者年龄。在某些类型的癌症中,如婴儿纤维肉瘤(一种罕见的疾病),这些重排的发生率很高(高达90%),但其发生率仅为所有恶性肿瘤的1%,这突出了识别预测性生物标记物对靶向抗癌药物治疗的重要性。
目前,为了应对靶向抗癌药物的重大挑战,已经应用了许多策略,如抗耐药突变的新一代抗癌药物、多靶向药物、联合治疗和针对中路干细胞的药物。除此之外,该领域的几个新研究趋势值得关注[1]。
第一个是针对新型癌症靶点的药物发现。例如,在过去几年中,一些新的表观遗传调控蛋白已经引起了越来越多的关注,例如RNA m6A甲基化相关蛋白(METTL3/14、FTO、ALKBH5、WTAP和YTHDFs)。微RNA(miRNA)是另一种新型癌症靶点,它们在癌症中经常失调,可能成为癌症治疗的有希望的靶点。目前,已经发现了一些针对miRNA的小分子抑制剂,如miR-21抑制剂AC1MMYR2(也称为NSC211332)、Lin28-let-7抑制剂6-羟基-DL-DOPA、SB/ZW/0065和KCB3602.
此外,一些以前被认为不可治疗的蛋白也可能是有吸引力的抗癌靶点。一个典型的例子是KRAS,一种最常见的RAS原癌基因突变异构体,在推动癌症的发生和发展中起着主导作用。因为内源性配体GTP与KRAS的高结合亲和力,KRAS的相对较小尺寸和光滑表面,以及KRAS开关区域的高度灵活性,过往几十年都未能成功开发靶向小分子。然而,这种困境最近开始改变。目前正在开发多种直接靶向KRAS的新型小分子,包括KRAS G12C突变体的共价变构抑制剂、结合在开关I/II口袋或A59位点的蛋白-蛋白相互作用抑制剂,以及靶向核苷酸结合位点的GTP竞争性抑制剂。迄今为止,具有类似变构机制的四种KRAS G12C共价抑制剂(AMG510、JNJ-74699157、MRTX849和GDC-6036)已进入临床试验。除KRAS外,其他类型的此类先前无法治疗的癌症靶点包括MYC、磷酸酶、和蛋白-蛋白相互作用等。
第二种方法是将小分子靶向药物与PD-1抗体等免疫疗法相结合。乐伐替尼+K药于2018年被FDA指定为晚期或转移性肾细胞癌(RCC)患者的突破性治疗。接受联合治疗的所有RCC患者的ORR为63.3%,一线治疗组为83.3%。K药与另一种小分子抗血管生成药物阿西替尼的联合治疗已被批准用于晚期肾细胞癌患者。这也是首个被FDA批准用于晚期肾细胞癌一线治疗的PD-1抗体与靶向药物联合治疗。
第三种是抗体药物结合物(ADC)药物。尽管由于耦合技术、靶向性和有效性的限制,第一种ADC药物(Mylotarg,辉瑞)在2010年遭遇挫折,但人们并未对ADC药物失去信心。随着抗体结合技术的改进,10种ADC药物,如polatuzumab-vedotin-piiq(Polivy)、enfortumab-vedotin-ejfv(Padcev),fam-trastuzumab deruxtecan-nxki(Enhertu)、sacituzumab govitecan-hziy(Trodelvy)和belantamab Mafoodin-blmf(Blenrep)在过去十年中已获得FDA批准。ADC药物将是未来的一个重要发展方向。
第四种是PROTAC,它利用小分子招募目标蛋白进行泛素化和蛋白酶体去除。PROTAC技术不同于传统的“靶向占领”抑制剂疗法,它通过催化目标蛋白的降解来降低目标蛋白的活性。由于目标蛋白生物合成缓慢,这种方法可以大大减缓目标蛋白活性的恢复。PROTAC是一种迅速出现的替代治疗策略,有可能解决现代药物开发项目当下面临的许多挑战。目前,由PROTAC technology设计的两种药物(ARV-110和ARV-471)已进入临床试验。这两种药物均由Arvinas开发,并于2019年获得FDA批准用于第一阶段临床试验。其中,ARV-110特异性结合雄激素受体(AR)并介导AR降解,用于治疗转移性去势抗性前列腺癌(CRPC)患者。ARV-471是一种ER蛋白降解剂。在临床前研究中,ARV-471几乎完全导致肿瘤细胞中的内质网降解,并在多种内质网驱动的异种移植模型中表现出强烈的生长抑制效应。目前正在对其用于治疗局部晚期或转移性ER+/HER2-乳腺癌患者进行临床评估。
第五个是联合致死性。这意味着两个基因中任何一个单独的功能丧失对癌细胞的生存能力几乎没有影响,但是,由于基因突变/缺失或药物抑制,这两个基因同时失活,导致细胞死亡。正常细胞由于缺乏固定的基因改变,通常不会受到合成致死性的影响。联合致死的概念在靶向治疗的发展中已经使用了很多年:最流行的例子是KRAS突变癌模型中BCL-XL和MEK联合抑制的致死性相互作用,以及PARP抑制剂在BRCA突变卵巢癌中的成功临床应用。尽管这不是一个新想法,联合致死性为一些已知的癌症基因驱动因素提供了一种替代治疗策略,这些因素由于其分子结构(不可治疗的癌基因)或导致功能丧失(肿瘤抑制基因)而无法直接靶向。因此,联合致死性在推动发现新的抗癌靶点以及随后开发有效药物或组合策略方面具有巨大潜力,这些药物或组合策略仍然是大多数癌症所需要的。
总之,尽管存在大分子药物的竞争,但小分子靶向药物由于其独特的优势将继续成为癌症治疗的主流。随着对肿瘤病理学的深入了解和新药研发技术的发展,笔者相信在不久的将来将开发更多针对新基因或作用机制的新型小分子抗癌药物。预计在未来十年中,一些新领域,如小分子靶向药物与肿瘤免疫治疗、ADC和PROTAC的结合将获得重大发展。
参考文献:
[1] Zhong, L., Li, Y., Xiong, L. et al. Small molecules in targeted cancer therapy: advances, challenges, and future perspectives. Sig Transduct Target Ther 6, 201 (2021). 网页链接