中国国家药监局药品审评中心(CDE)官网最新公示,默沙东1类新药注射用sotatercept获得临床试验默示许可,拟开发治疗肺动脉高压。公开资料显示,该药是一款新型激活素信号抑制剂类生物制剂,是默沙东通过115亿美元收购Acceleron Pharma公司所得。默沙东已向美国FDA递交了该药的生物制品许可申请(BLA),用于治疗成人肺动脉高压。此前,该药还被行业媒体Evaluate列为2023年有望获批的十大潜在重磅疗法之一。
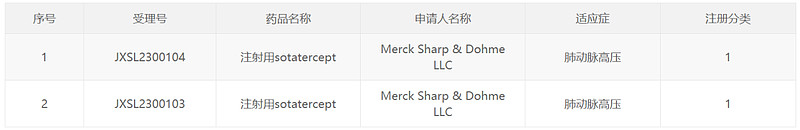
图片截图来源:CDE官网
肺动脉高压(PAH)是一种罕见、进行性、危及生命的血管疾病,其特征为肺小动脉收缩和肺循环中血压升高。PAH可引起心脏负荷明显增加,导致体力活动受限、心力衰竭和预期寿命缩短。
Sotatercept是Acceleron Pharma开发的一款潜在“first-in-class”IIA型激活素受体(ActRIIA)融合蛋白。公开资料显示,该产品通过将ActRIIA经过改造的细胞外域与抗体的Fc端融合在一起,可以阻断激活素与细胞膜上的受体结合,从而降低激活素介导的信号传导。在临床前研究中,它可以逆转肺动脉壁和右心室的重塑。
2021年9月,默沙东完成了对Acceleron公司的收购,从而获得了这款创新疗法。Sotatercept此前已经获得FDA授予的突破性疗法认定。默沙东在2023年第二季度财报中曾表示,其已经向FDA递交sotatercept的生物制品许可申请。

Sotatercept此前已经在关键3期STELLAR临床研究中达到主要终点。该研究评估了sotatercept联合稳定背景治疗用于治疗肺动脉高压成人患者(WHO组1)的有效性和安全性。该研究数据在第72届美国心脏病学会(ACC)年会暨世界心脏病学大会(WCC)上正式发布,并在《新英格兰医学杂志》同步发表。
2023年3月,默沙东公布了STELLAR研究的完整结果。研究数据显示,在PAH患者中,sotatercept在治疗24周后将患者的6分钟行走距离(6MWD)与基线相比提高40.8米,达到试验主要终点。此外,sotatercept还对9项次要终点中的8项提供统计显著和具有临床意义的改善。与安慰剂相比,在中位随访时间为32.7周时,它将患者的疾病临床恶化或死亡风险降低84%。
默沙东此前新闻稿表示,该研究公布对医生和患者具有重要意义,它表明sotatercept可能在改善肺动脉高压患者运动能力和其他有意义的临床结局指标方面发挥关键作用。且在稳定背景治疗的基础上,接受sotatercept治疗患者的死亡或临床恶化风险显著降低。这些具有里程碑意义的结果彰显了sotatercept在肺动脉高压治疗领域的潜力。
参考资料: [1]中国国家药监局药品审评中心(CDE)官网.Retrieved Aug 29,2023, From 网页链接 [2]Merck Announces Second-Quarter 2023 Financial Results. Retrieved Aug 1,2023, From 网页链接 [3] Merck Announces Positive Top-line Results from Pivotal Phase 3 STELLAR Trial Evaluating Sotatercept for the Treatment of Adults with Pulmonary Arterial Hypertension (PAH). Retrieved October 10, 2022, from 网页链接
@药明康德 内容团队编辑
版权说明:本文来自药明康德内容团队,欢迎个人转发,谢绝媒体或机构未经授权以任何形式转载至其他平台。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
⤵️喜欢我们的内容,欢迎关注@药明在线 ,或者点赞、分享给其他读者吧!