8月30日,中国国家药监局药品审评中心(CDE)官网最新公示,百济神州递交了抗PD-1单抗替雷利珠单抗注射液的新适应症上市申请,并获得受理。公开资料显示,这是该产品在中国递交的第13项适应症上市许可申请,此前该药已在中国获批11项适应症,另有一项适应症的上市申请正在审评中。
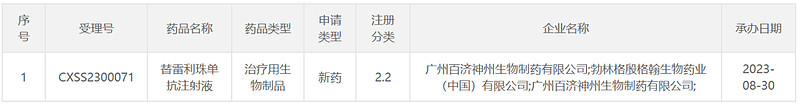
截图来源:CDE官网
替雷利珠单抗(商品名:百泽安)是一款人源化IgG4抗程序性死亡受体-1(PD-1)单克隆抗体,设计目的旨在最大限度地减少与巨噬细胞中的Fcγ受体结合,帮助人体免疫细胞检测和对抗肿瘤。临床前数据表明,巨噬细胞中的Fcγ受体结合之后会激活抗体依赖细胞介导杀伤T细胞,从而降低了抗PD-1抗体的抗肿瘤活性。目前,替雷利珠单抗全球临床开发项目已在超过30个国家和地区开展超过20项注册相关的试验,入组超过1.2万例患者。
在中国,替雷利珠单抗已获批11项适应症,涵盖非小细胞肺癌(NSCLC)、经典型霍奇金淋巴瘤、尿路上皮癌、肝细胞癌、食管鳞状细胞癌(ESCC)、鼻咽癌、胃或胃食管结合部(G/GEJ)腺癌等等。其中,包括于今年在中国获批的两项新适应症:联合化疗用于一线治疗不可切除的局部晚期、复发或转移性ESCC,以及一线治疗肿瘤表达PD-L1的晚期或转移性G/GEJ腺癌患者。此外,该产品用于一线不可切除或转移性肝细胞癌(HCC)的上市申请目前也正在审评中。

根据8月2日百济神州发布的2023年第二季度财务业绩,替雷利珠单抗的预计里程碑事件为:在中国递交用于一线治疗广泛期小细胞肺癌的注册申报工作。小细胞肺癌(SCLC)是肺癌中侵袭性最强的亚型,约占所有肺癌病例的15%-20%,具有进展迅速、早期转移、预后差等特点。SCLC分为局限期(LS-SCLC)和广泛期(ES-SCLC)。大部分患者在就诊时已被诊断为ES-SCLC,中位生存期不足1年,2年生存率不到10%,仍是临床未解决的一大难题。
今年5月,百济神州宣布替雷利珠单抗联合化疗用于未经治疗的ES-SCLC患者的3期临床试验RATIONALE-312达到主要终点。这是一项对比替雷利珠单抗联合化疗(A组)和安慰剂联合化疗(B组)作为未经治疗的ES-SCLC患者一线治疗有效性的随机、双盲、安慰剂对照、多中心3期临床试验。试验主要终点为总生存期(OS),次要终点包括客观缓解率、缓解持续时间(根据RECIST v1.1版)和无进展生存期。结果显示,相较于化疗,联合疗法在未经治疗的ES-SCLC患者中展现出OS优效性。试验未发现新的安全性警示。百济神州曾在新闻稿中表示,将在9月份举行的2023年世界肺癌大会上口头报告RATIONALE-312试验结果。
@药明康德 内容团队编辑
版权说明:本文来自药明康德内容团队,欢迎个人转发,谢绝媒体或机构未经授权以任何形式转载至其他平台。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
⤵️喜欢我们的内容,欢迎关注@药明在线 ,或者点赞、分享给其他读者吧!