7月10日,中国国家药监局药品审评中心(CDE)官网公示,和黄医药呋喹替尼胶囊拟纳入突破性治疗品种,拟定适应症为:联合抗PD-1单抗信迪利单抗注射液用于既往至少一线含铂治疗失败的错配修复完善(pMMR)晚期子宫内膜癌患者。信迪利单抗是信达生物和礼来(Eli Lilly and Company)合作开发的一款创新PD-1抑制剂,此前已在中国获批治疗多个肿瘤适应症。
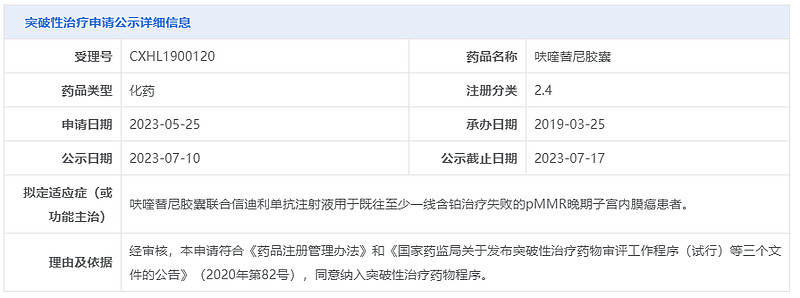
截图来源:CDE官网
呋喹替尼是一种高选择性、强效的口服血管内皮生长因子受体(VEGFR)-1、-2及-3抑制剂,其独特设计使其激酶选择性更高,旨在尽可能地降低脱靶毒性、改善耐受性及对靶点提供更稳定的覆盖。此前,该药已在中国获批用于既往接受过氟嘧啶、奥沙利铂和伊立替康治疗的转移性结直肠癌患者,包括既往接受过抗VEGF治疗或抗EGFR治疗(RAS野生型)的患者。公开资料显示,目前和黄医药正在开发呋喹替尼和抗PD-1单克隆抗体联合疗法用于治疗子宫内膜癌及其它实体瘤的临床试验。
2023年3月,武田(Takeda)与和黄医药达成独家许可协议,在除中国大陆、香港和澳门地区以外的全球范围内进一步推进呋喹替尼针对所有适应症的开发和商业化。2023年5月,美国FDA受理呋喹替尼用于治疗经治转移性结直肠癌成人患者的新药上市申请,并授予其优先审评资格。2023年6月,欧洲药品管理局(EMA)已确认并受理呋喹替尼用于治疗经治转移性结直肠癌成人患者的新药上市申请。

根据CDE公示,此次喹替尼胶囊拟纳入突破性治疗品种的申请针对的是pMMR晚期子宫内膜癌患者。子宫内膜癌(EC)是常见的妇科恶性肿瘤。大多数EC患者能够早期诊断,初诊时I-II期占70%,III-IV期占30%。晚期EC患者的复发率约为52%,且预后较差,5年生存率低于20%。目前临床中对于晚期或复发性EC可选择的治疗方案有限,以PD-1为靶点的免疫检查点抑制剂联合或不联合抗血管生成药物,是EC患者二线或后续治疗的有效治疗方案。
虽然免疫检查点抑制剂改善了子宫内膜癌的临床结果,但有很大一部分患者对免疫检查点抑制剂没有响应,最初有响应的患者最终也会产生耐药性。与VEGFR抑制剂的联合疗法可以通过抑制肿瘤区域的血管生成,抑制肿瘤生长并减少转移,从而提高免疫检查点抑制剂的临床疗效。
2018年11月,和黄医药与信达生物达成全球临床合作,评估呋喹替尼与信达生物信迪利单抗联合治疗实体瘤患者的安全性和耐受性。本次拟纳入突破性治疗品种是该联合疗法的又一重要研究进展。希望呋喹替尼与信迪利单抗联合疗法在后续临床研究中取得更多突破,早日为患者带来新的治疗选择。
@药明康德 内容团队编辑
本文来自药明康德内容团队,欢迎转发,谢绝转载到其他平台。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
⤵️喜欢我们的内容,欢迎关注@药明在线 ,或者点赞、分享给其他读者吧!