5月17日,中国国家药监局药品审评中心(CDE)官网公示,Idorsia公司与先声药业共同递交了5.1类新药盐酸daridorexant片的临床试验申请并获得受理,拟用于治疗成人失眠患者。公开资料显示,这是一款双食欲素受体拮抗剂,已获得美国FDA批准用于治疗失眠症成人患者,先声药业通过一项5000万美元的合作获得了该产品中国独家权利。
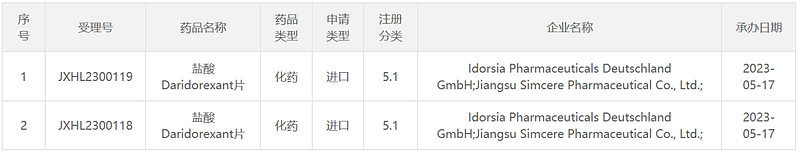
截图来源:CDE官网
失眠症是一种严重的睡眠障碍。公开资料显示,失眠的主要症状表现为入睡困难(入睡潜伏期超过30分钟)、睡眠维持障碍(整夜觉醒次数≥2次)、早睡、睡眠质量下降和总睡眠时间减少(通常小于6.5小时),同时伴有日间功能障碍。
根据先声药业早前发布的新闻稿,Idorsia公司的研究团队一直致力于食欲素及其受体领域的科学研究,并发现对食欲素系统的拮抗可让失眠患者保持自然睡眠结构,由此开发出双食欲素受体拮抗剂daridorexant。它通过阻断促进觉醒的神经肽——食欲素与其受体结合,从而降低过度活跃的中枢觉醒。与一般通过镇静大脑来诱导睡眠的疗法不同,daridorexant仅阻断食欲素受体的启动,因此可减少唤醒驱动,诱导睡眠发生,而不改变睡眠阶段的比例,且没有次日残留效应。

2022年1月,daridorexant在美国获批上市(商品名为Quviviq),用于治疗失眠症成人患者。同年11月,先声药业与Idorsia公司共同宣布,双方已就该药在中国的开发签订独家许可协议。根据协议,先声药业将获得在中国内地、香港和澳门地区开发和商业化daridorexant的独家权利,负责在中国开展该项目的临床研发;Idorsia公司将获得3000万美元的首付款,并有资格在中国注册获批后获得2000万美元额外里程碑付款等。
此前,daridorexant治疗失眠症的3期关键性临床试验数据已经发表于《柳叶刀-神经病学》杂志。主要研究表明,在治疗的第1个月及第3个月,daridorexant较安慰剂显著改善了入睡、睡眠维持,以及自我报告的总睡眠时间。接受daridorexant 50mg治疗的受试者,在治疗的第三个月,持续睡眠潜伏期(LPS)显著下降34.8分钟,入睡后醒来时间(WASO)显著下降29.4分钟,自我报告的总睡眠时间(sTST)显著增加57.7分钟。以此计算,服用daridorexant的患者每周相当于增加近一整晚的睡眠。
@药明康德 内容团队编辑
本文来自药明康德内容团队,欢迎转发,谢绝转载到其他平台。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
⤵️喜欢我们的内容,欢迎关注@药明在线 ,或者点赞、分享给其他读者吧!