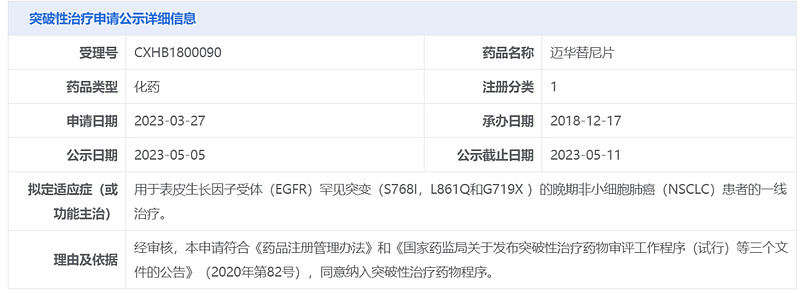
今日(5月5日),中国国家药品监督管理局药品审评中心(CDE)官网最新公示,由华东医药全资子公司中美华东申报的1类新药迈华替尼片拟纳入突破性治疗品种,针对适应症为:用于表皮生长因子受体(EGFR)罕见突变(S768I,L861Q和G719X)的晚期非小细胞肺癌(NSCLC)患者的一线治疗。公开资料显示,迈华替尼(mefatinib)是一款泛EGFR抑制剂,华东医药正在开展该药的3期临床研究。
截图来源:CDE官网
据文献报道,迈华替尼是一款新型、第二代、不可逆的泛EGFR抑制剂,拟用于治疗晚期EGFR敏感突变非小细胞肺癌。该药旨在不可逆地结合EGFR和HER2突变的酪氨酸激酶结构域。临床前研究表明,单药迈华替尼对携带EGFR或HER2过表达、以及EGFR突变的肺癌具有较强的抑制活性。
本次,迈华替尼拟纳入突破性治疗品种,针对的适应症为EGFR罕见突变(S768I,L861Q和G719X)的晚期NSCLC患者的一线治疗。公开资料显示,大多数EGFR突变阳性的NSCLC病例属于常见的EGFR突变,即外显子19缺失和L858R。约有10%的EGFR突变的NSCLC患者具有罕见突变(S768I,L861Q和G719X),这部分患者仍然存在未被满足的治疗需求。

根据中国药物临床试验登记与信息公示平台,华东医药正在开展一项随机、平行、双盲双模拟、多中心的3期临床,探索迈华替尼对比吉非替尼一线治疗EGFR敏感突变的晚期非鳞状NSCLC的安全性和有效性。
2021年11月,Signal Transduction and Targeted Therapy杂志曾在线发表迈华替尼一项临床研究结果。这是一项1b/2期开放、单臂、多中心研究,评估了迈华替尼在晚期EGFR敏感突变NSCLC患者的一线治疗中的疗效和安全性。研究结果显示,106名EGFR突变的IIIB-IV期NSCLC患者的总体客观缓解率(ORR)达84.9%,疾病控制率(DCR)为97.2%。主要研究终点中位无进展生存期(PFS)为15.4个月,中位总生存期(OS)为31.6个月。29%的患者存在基线脑转移,这部分患者的ORR也达87.1%,PFS为12.8个月,OS为25.2个月。迈华替尼的不良反应主要涉及皮肤和胃肠道毒性,耐受性良好且可控。
根据华东医药近日发布的2023年一季度报告,迈华替尼片已经于2021年6月完成3期临床末例受试者入组,目前正在进行PFS事件数随访,预计2023年第二季度获得3期研究PFS事件数后开展上市申报工作。
@药明康德 内容团队报道
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文由药明康德内容团队根据公开资料整理编辑,欢迎个人转发,谢绝媒体或机构未经授权以任何形式转载至其他平台。