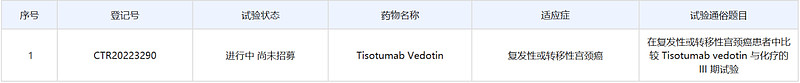
12月22日,中国药物临床试验登记与信息公示平台官网公示,“first-in-class”抗体偶联药物(ADC)tisotumab vedotin启动了一项国际多中心(含中国)3期临床研究,针对适应症为二线或三线复发性或转移性宫颈癌患者。公开资料显示,这是一种针对组织因子(TF)的抗体偶联药物,已在美国获批用于治疗复发或转移性宫颈癌患者(商品名为Tivdak)。
截图来源:中国药物临床试验登记与信息公示平台
组织因子是一种能促进血管生成,肿瘤生长和转移的蛋白,在宫颈癌等多种实体瘤中高度表达。Tisotumab vedotin正是由Genmab公司靶向组织因子的单克隆抗体与Seagen公司ADC技术组成,它将细胞毒性药物MMAE通过一种可被蛋白酶切割的连接子偶联在单克隆抗体上。该产品被细胞内吞后释放MMAE,能够扰乱分裂细胞的微管网络,导致细胞周期停滞和细胞死亡。
2021年9月,美国FDA加速批准tisotumab vedotin上市,用于治疗复发或转移性宫颈癌患者。她们的疾病在接受化疗治疗后出现进展。2022年9月,再鼎医药和Seagen公司宣布,就tisotumab vedotin在大中华区的开发和商业化达成独家合作和许可协议。为此,Seagen公司将获得3000万美元的预付款,另加开发、注册及商业化里程碑付款及其它分级特许权使用费。

根据中国药物临床试验登记与信息公示平台,此次tisotumab vedotin启动的是一项随机、开放标签、国际多中心3期试验,旨在复发性或转移性宫颈癌患者中比较tisotumab vedotin与研究者所选化疗方案的临床疗效改善。该试验计划在全球150家研究中心开展,计划在国际入组482人,在中国入组74人。该研究的中国部分由中国医学科学院肿瘤医院主任医师吴令英博士担任主要研究者,主要终点指标为治疗第21周的总生存期(OS)。
此前,tisotumab vedotin已在治疗复发和/或转移性宫颈癌患者的关键性2期临床试验中取得积极结果。这些患者曾经接受过双联化疗,或者贝伐单抗作为一线疗法。试验结果显示,tisotumab vedotin达到24%的客观缓解率(ORR),中位缓解持续时间(DOR)为8.3个月。
宫颈癌是女性常见的恶性癌症之一,也是女性癌症死亡的主要原因之一。宫颈癌在早期发现并得到有效管理时通常可以治愈,但在疾病晚期或癌症扩散时,治疗选择有限。复发或转移性宫颈癌患者预后较差,5年生存率不到20%。
希望tisotumab vedotin这款创新ADC在中国的临床研究进展顺利,早日为更多宫颈癌患者带来新的治疗选择。
参考文献:
[1]中国临床试验登记与信息公示平台. Retrieved Dec 22,2022, From 网页链接
[2]再鼎医药和Seagen宣布就TIVDAK® 达成区域战略合作和许可协议. Retrieved Sep 27 , 2022. From 网页链接
[3] Genmab and Seagen Announce FDA Accelerated Approval for TIVDAK™ (tisotumab vedotin-tftv) in Previously Treated Recurrent or Metastatic Cervical Cancer. Retrieved September 20, 2021, from 网页链接
@药明康德 内容团队报道
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文由药明康德内容团队根据公开资料整理编辑,欢迎个人转发,谢绝媒体或机构未经授权以任何形式转载至其他平台。