▎药明康德内容团队报道
10月18日,中国药物临床试验登记与信息公示平台显示,默沙东(MSD)与Seagen公司等已在中国启动了一项tucatinib治疗局部晚期或转移性HER2阳性乳腺癌的3期临床。Tucatinib是一款对HER2具有高度特异性的小分子口服抑制剂,已在美国获批用于治疗晚期HER2阳性乳腺癌成人患者。该药曾获得FDA授予的快速通道资格、孤儿药资格和突破性疗法认定。

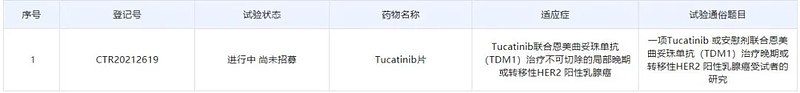
截图来源:药物临床试验登记与信息公示平台
在乳腺癌患者中,很多患者会过度表达人类表皮生长因子受体2(HER2),HER2蛋白会促进癌细胞的生长,严重影响患者的治疗和预后。公开资料显示,超过25%的转移性HER2阳性乳腺癌女性患者会发生脑转移。
Tucatinib是Seagen公司开发的一种口服酪氨酸激酶抑制剂,对HER2具有高度特异性,但对同属人表皮生长因子受体家族的EGFR没有明显抑制作用。2020年4月,FDA批准tucatinib上市,与曲妥珠单抗和卡培他滨联用治疗手术无法切除或转移性经治晚期HER2阳性乳腺癌成人患者。
2020年9月,默沙东与Seagen公司达成一项合作,获得了tucatinib在亚洲、中东和拉丁美洲,以及其他地区(美国、加拿大和欧洲以外的地区)的独家商业化权益,用于治疗HER2阳性癌症。在这项合作中,Seagen公司获得1.25亿美元的首付款,并有资格获得高达6500万美元的里程碑付款。

本次在中国启动的是一项随机、双盲的国际多中心3期临床试验(HER2CLIMB-02),旨在评估比较tucatinib或安慰剂联合恩美曲妥珠单抗治疗不可切除的局部晚期或转移性HER2阳性乳腺癌的疗效和安全性。
根据中国药物临床试验登记与信息公示平台信息,该试验由中国医学科学院肿瘤医院徐兵河教授担任主要研究者,将在中国24个临床试验机构进行,计划在中国境内入组105例患者。试验的主要终点是比较两治疗组的无进展生存期(PFS),关键次要终点是比较两治疗组的总生存期(OS)、客观缓解率(ORR)。
值得一提的是,tucatinib的3期研究HER2CLIMB曾被美国临床肿瘤学会(ASCO)评为2020年抗癌领域20项重要临床研究之一。研究显示,在标准治疗药物曲妥珠单抗和卡培他滨的基础上加入HER2靶向疗法tucatinib,可显著提高患者的PFS,将患者的疾病进展或死亡风险降低46%。此外,三联疗法还改善了患者的OS,将患者死亡风险降低了34%。
期待tucatinib在中国的3期临床试验也顺利进行,并取得好的结果,早日为患者带来新的治疗选择!
参考文献:
[1]中国药物临床试验登记与信息公示平台. Retrieved Oct 18,2021, from 网页链接
[2] FDA Approves First New Drug Under International Collaboration, A Treatment Option for Patients with HER2-Positive Metastatic Breast Cancer. Retrieved April 17, 2020, from 网页链接
[3] Seattle Genetics and Merck Announce Two Strategic Oncology Collaborations. Retrieved September 14, 2020, from 网页链接
本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。