
“iMeta焦点” :
艾美达医药咨询聚焦热点政策、解读背后趋势的专栏,与行业人士一同关注和见证中国医药监管的变化。
近日,国内首个司美格鲁肽生物类似药上市申请受理的消息引起行业内广泛讨论。作为近些年慢性病领域的标志性产品,司美格鲁肽自2017年于美国首次批准上市起即受到多方关注,并于2021年进入我国市场用于2型糖尿病治疗,其后续的减肥相关适应症获得FDA批准后,全球销售额持续保持高速增长,大有一举成为全球“药王” 之势。
司美格鲁肽的核心专利到期时间为2026年,并且依据现行的专利链接制度,即便生物类似药上市后也无法启动商业化,为何会有企业早早的申报生物类似药上市?
01
司美格鲁肽的核心专利之争
尽管此次申报生物类似药上市的企业为九源基因,但是引发行业广泛讨论的起因却源于另一家公司-华东医药。
2021年6月,华东医药旗下的中美华东制药向国家知识产权局递交司美格鲁肽核心专利的无效申请,在2022年9月国家知识产权局即宣告原研司美格鲁肽GLP-1化合物专利全部无效,理由是诺和诺德“未公开司美格鲁肽核心化合物的实验结果数据”。
诺和诺德在2023年上诉至北京知识产权法院,且由于北京知识产权法院与国家知识产权局对此案持不同结论,目前该案已经上诉至最高人民法院知识产权庭。
从国家知识产权局披露的文件以及近一两年业界的讨论内容可以看出,此案争论的关键点在于诺和诺德作为专利权方的补交数据是否应予以接受。
其实在知识产权领域,药品专利的补充实验数据是否应该被接受已经是一个老生常谈的话题,且至今依然尚无明晰的界定规则。那么为什么药企们要追着这个专利的细节问题不放呢?笔者认为去除其他因素,最重要的原因在于仅凭专利不能够完全对创新药尤其是创新生物制品进行全方位的知识产权保护。
与化学药相比,生物制品分子量大、结构复杂,在理化性质、生物活性、免疫原性等方面存在显著差异,无法像化学药一样得到较宽的专利保护范围,通常情况下得到的专利授权保护范围较窄、力度较弱。
在这种情况下,企业在专利申请时将部分技术秘密隐藏便成为了必然的选项,然而技术隐藏带来的后果就是专利容易被起诉无效。从现在的情况来看,对于创新药尤其是专利保护力度更小的新作用机制或新靶点的创新药而言,貌似陷入了进退两难的僵局。
02
数据保护制度是解开僵局的关键
在知识产权保护体系中除了专利之外,还有一项重要内容就是数据保护制度,尤其是对于专利保护力度较弱的创新药品种而言尤为重要。
数据保护制度最早源自于美国的Hatch-Waxman法案,从国际经验来看,药品数据保护制度的设立主要源于两种理论依据,即以美国、欧盟等为代表的创新激励为目的和以日本为代表的新药安全监控为目的。
从保护方式上来看,主要分为“不披露”、“不依赖(即不依赖被保护数据批准仿制药上市)”、“不受理”三个等级。
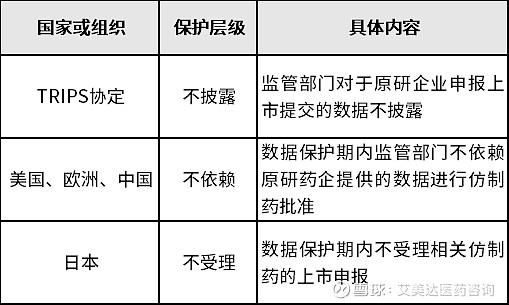
我国对于新药的数据保护制度源于加入WTO时对于贸易有关的知识产权协定(TRIPS)的承诺,并在TRIPS协定的基础上进一步升级为“不依赖”。我国于2002年发布施行的《药品管理法实施条例》做出规定:
“自药品生产者或者销售者获得生产、销售新型化学成份药品的许可证明文件之日起6年内,对其他申请人未经已获得许可的申请人同意,使用前款数据申请生产、销售新型化学成份药品许可的,药品监督管理部门不予许可;但是,其他申请人提交自行取得数据的除外。”
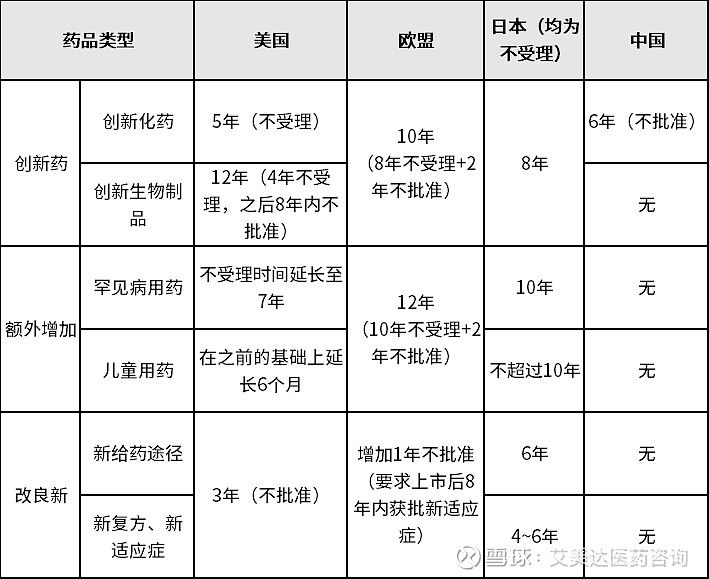
从保护时间上来看美国对创新药根据不同的药物类型进行分类,创新生物制品的保护时间远长于化药,欧盟和日本对于创新药进行统一规定。美国、欧盟、日本对于罕见病用药和儿童用药均有额外延长,且对于改良新药也有一定的数据保护时间。
但是中国目前的政策依旧停留在2002年发布的《药品管理法实施条例》相关内容,仅对于创新化药有6年的保护期,对于其他类型的创新药或改良新药等无任何数据保护。尽管从专业角度而言,创新生物制品才是对数据保护需求最为强烈的药品,且罕见病和儿童药等市场空间较小的品种更需要数据保护以激励研发。
03
结语
在“创新驱动”和“健康中国”等国家战略的引领下,随着医药审评审批制度改革的不断深化,我国医药创新环境得以大幅改善,医药创新行业得以飞速发展。与2002年相比我国的医药创新水平已经有了质的提升,创新能力已经跃居世界第二梯队,但是我国的数据保护制度依然停留在2002年的水平。
其实我国2018年时已经发布《数据保护药品试验数据保护实施办法(暂行)(征求意见稿)》,并对不同的药物类型和创新水平给予不同的数据保护期,只是后续由于各种原因导致迟迟没有正式文件出台。
2023中央经济工作会议指出,要以科技创新推动产业创新,特别是以颠覆性技术和前沿技术催生新产业、新模式、新动能,发展新质生产力。而在今年两会首次出现在政府工作报告中的“创新药”更是新质生产力的代表之一。在当今的产业背景下,药品数据保护制度的完善已经成为必然的选项。
作者:张洋洋
*声明:本文不构成任何投资建议,仅出于传递更多信息之目的。
------------------------------
「长按」二维码添加小达「进群」
与更多行业伙伴共探市场前沿资讯
艾美达医药咨询
艾美达(北京)医药信息咨询有限公司,成立于2014年4月,是一家专业的医药行业咨询服务提供商。公司致力于将产业政策研究与真实世界的数据挖掘深度结合,洞悉行业政策对市场的影响,通过专业的研究提供前瞻性的市场分析,为企业产品上市后的市场准入提供整体解决方案。