3月18日,一个两党参议员小组发布了一封致国防部长Lloyd Austin的信,试图围绕改善供应链安全施加压力,以最大限度地减少可能发生的药品短缺,尤其是完全来自中国等外国的药品。
国防部的一份报告(Report on the Department of Defense Pharmaceutical Supply Chain Risks)显示,美国食品药品监督管理局基本药物清单上27%的药物被国防后勤局归类为“风险非常高”,因为它们要么依赖于使用中国活性成分的中国制造商,要么依赖于来源不明的药物。
根据参议员Elizabeth Warren(马萨诸塞州民主党)、Marco Rubio(佛罗里达州共和党)、Richard Blumenthal(康涅狄格州民主党)和其他六人发出的信函,2022年,该机构检查的211种药物中,46种来自中国,126种原料药来自印度。
议员们表示:“这些发现指出了加强和确保部门药品供应链的紧迫性。”他们特别指出了可能存在问题的tacrolimus(用于防止器官排斥的免疫抑制剂)的仿制药版本,这种药物被用于治疗在战斗中失去肢体的士兵。印度制药公司Intas Pharmaceuticals生产了这种药物,该公司也因FDA检查后发现的质量缺陷被迫关闭其生产地点,导致了该药物的短缺。
国防部已开始对供应链风险进行调查,去年8月与测试公司Valisure合作,对供应商进行质量评级。同时,在国会的部门,立法者正在对总部位于中国的或附属公司进行调查,包括药明康德和华大基因,因其涉嫌与政府有联系。
该报告是《2023年国防授权法案 》(2023 National Defense Authorization Act)的成果,该法案指示国防部制定更好的药品供应链风险管理指南,报告供应链脆弱性,并建立一个工作组来制定稀缺药品资源分配政策。
参议员们正在寻求关于工作组状态的最新信息以及国防部所有制药供应链中断的全面清单等问题。
01
信件全文

亲爱的 Austin 部长:
我们就美国国防部(DoD或该部)为实施2023财年(FY23)国防授权法案(NDAA)第860条而作的努力写此信件,该条款源于《加强军人供应链安全法案》(Strengthening Supply Chains for Servicemembers and Security Act),旨在解决军事药品供应链的风险。第860节指示国防部制定该部门药品供应链风险管理的指导方针,报告供应链漏洞,并建立一个工作组来制定分配稀缺药品资源的政策。
2023年,药品短缺达到自2014年以来的最高水平,去年的短缺包括300多种药品在内。许多药品短缺都是针对仿制药的。这些短缺对患者可能产生深远的影响,导致他们延迟或放弃必要的治疗。虽然药物短缺的原因有很多,但因质量缺陷导致的供应链中断是一个日益严重的问题。在许多情况下,只有少数制药公司生产特定的仿制药。当这些公司遇到质量问题或生产挑战时,供应链将承受巨大压力,导致广泛的供应中断。
此外,2022年供应美国市场的药品生产商中有58%位于海外。这使得药品供应链暴露于潜在的安全风险中,因为联邦监管机构在印度、中国和其他外国国家进行监督的能力有所降低。现实使得美国人很难确保整个供应链中产品和原料的质量。
军队也无法幸免于此。例如,最近的一份报告显示,“给予在战斗中失去肢体的士兵的[tacrolimus,一种用于防止器官排斥的免疫抑制剂]的某些仿制版本可能不起作用。”印度制造商Intas Pharmaceuticals生产了有缺陷的tacrolimus,因为美国食品和药物管理局(FDA)的调查揭示了其缺陷,导致该工厂关闭,也造成了其肿瘤药物的短缺。
基于以上原因,我们对去年八月国防部宣布打算与独立实验室Valisure签订合作协议,以进行一项试点研究,对十二种常用药物——从降血压药到抗抑郁药——“通过独立采购和测试”生成客观的药品质量数据,有着极大的兴趣。根据Valisure的公告,国防部领导“确定工作组应进行物流风险评估和质量风险评估”,并且“[一些]物流[信息]可能通过这项研究的执行产生”,但“这个研究项目的主要目的是评估质量”。Valisure在一份声明中分享,其测试可以帮助国防部和其他联邦机构“区分可用制造商的质量”,并“奖励优质制造商,排除次品药物的消费”。
根据《2023财年国防授权法案》第860节的要求,报告显示,美国食品和药物管理局(FDA)基本药物清单上的27%的药物被美国国防后勤局(DLA)列为“极高风险”,因为它们要么“依赖中国制造商使用中国活性药物成分(API)”,要么是“来源不明的药物”。报告进一步发现,在2022年DLA检查的211种药物中,46种来自中国,126种API来自印度。这些发现强调了加强和保护国防部药品供应链的紧迫性。
我们感谢DoD对这些重要问题的关注,并期待加强我们药品供应链的韧性。为此,我们请求您在不迟于2024年4月1日之前提供以下问题的答案:
1.请描述DoD为实施FY23 NDAA第860节所采取的步骤。
a.工作组旨在评估药品供应链的风险、识别对军事治疗设施受益者护理最为关键的药品,并在供应中断期间建立分配稀缺药品的政策,该工作组的现状如何?
i.工作组的成员有哪些?
ii.工作组是否已经召开会议?
iii.工作组的工作成果是什么?
iv.我们什么时候可以期待工作组的首批成果与国会分享?
2.请提供一份全面的DoD药品供应链中断清单,包括:
a.此类中断的来源;
b.这种中断是否导致了药品短缺;
c.短缺问题是否已解决;
d.DoD为解决此类短缺问题所采取的行动;和
e.此类中断和/或短缺对服役人员和军事准备的影响。
3.DoD是否打算与该机构的医疗保健提供者以及那些开处方或管理这些药物的人分享《DoD药品供应链风险报告》的结果?
4.DoD监察长办公室2021年报告建议,DLA部队支援部门应与军方客户协调,对DLA的药品应急合同进行响应性测试,并将测试结果纳入Warstopper Program年度审查中。
a.请提供有关部门实施这一建议的最新进展。

02
信件背景
国防后勤局(DLA)是美国国防部最重要的药品采购组织。DLA每年采购约54亿美元,约占美国商业市场的2%。虽然采购总量不算大,但涉及范围很广。在卫生和公众服务部为美国市场确定的17555个通用序列号(GSN)中,DLA每年采购6589个(按药物家族约占37%)供国防部使用。
来自《国防部药品供应链风险报告》(Report on the Department of Defense Pharmaceutical Supply Chain Risks)的信息显示,为了与行政命令(EO)14017《提高关键美国供应链的韧性》(Improve Resiliency of Key American Supply Chains)以及EO 13953《解决对外国敌对势力依赖所带来的国内供应链威胁》(Address Threat to Domestic Supply Chain from Reliance on Foreign Adversaries)保持一致,美国国防部正在开发一套供应链风险管理(SCRM)框架。为了更有效地满足国防部药品供应链管理要求,国防部正在开发并维持药品来源解决方案(PPS),该方案将提供一种识别活性药物成分(API)及其相关风险和依赖关系的方法和手段。PPS将被纳入一般的国防部SCRM框架中,允许部门在SCRM分析中考虑特定的药品采购风险考虑因素。
根据报告分析的1,744个全球供应编号(GSN)药物,美国国防部高度依赖外国材料和贸易协定来维持当前的药品能力。尽管28%的活性药物成分(APIs)来源于北美,并被认为至少具有中等程度的安全性,但有5%来源于中国,22%的来源不明。总的来说,国防部已经确定,54%的国防部药品供应链被认为具有高度或非常高的风险,依赖于不符合《贸易协议法》(TAA)的供应商(“符合TAA”是指成品药和原料药或关键成分的来源均为美国制造或符合条件的国家或指定国家项目)、从中国和印度采购或来源不明。
03
来自中国药品竟全部被划为风险最高?
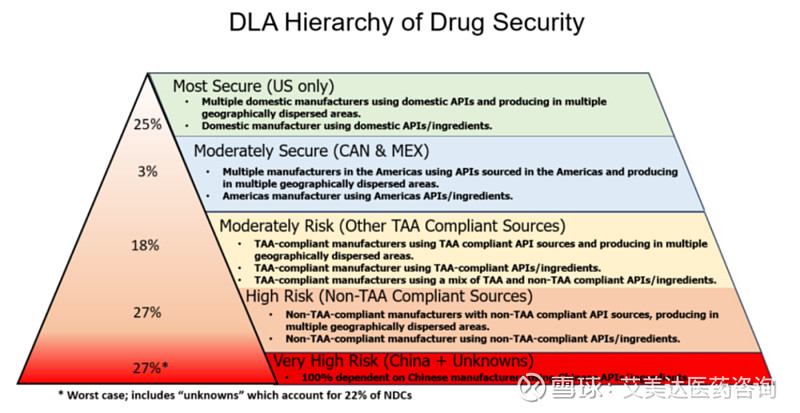
在报告中,将中国来源的药物来源单独列出,优先度定为了最低级。

同时,来自中国的药物也被评级为最高的风险度。其中,美国来源药物被定义为最安全,其实加拿大和墨西哥,再次是其他符合TAA的制造商,然后是除中国外不符合TAA制造商(比如印度),最后才是中国和来源不明的药物,而这部分药物一共占27%。
04
美国国防部对中国的依赖程度如何?
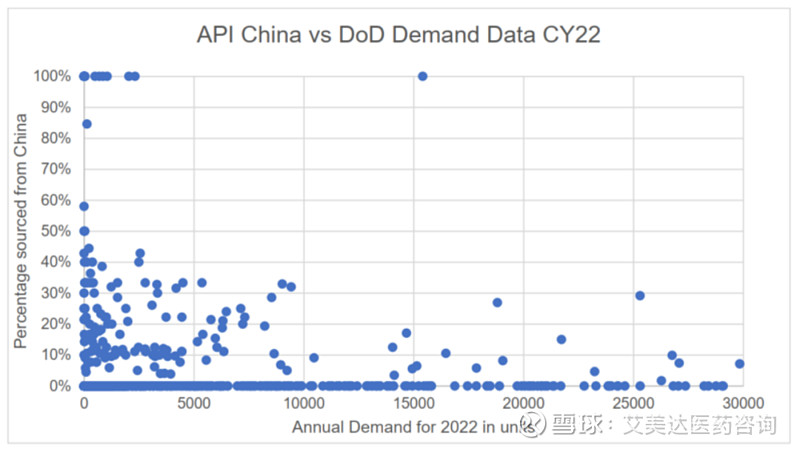
上图描述了DLA在2022财年购买的FDA基本药物清单中和其他药物中,所有46种药物(684个NDC)的活性药物成分(API)来自中国。
此外,采购的46种药物中有7种(20种NDC)的原料药完全来自中国,总量为22957单位。这些药物用于抗微生物、抗病毒药物、人粒细胞集落刺激因子和血糖控制剂。具体清单如下:

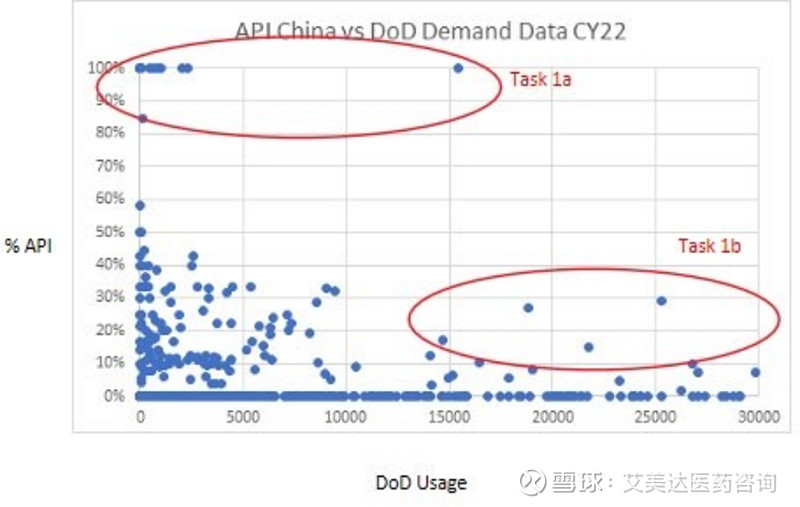
报告中,将替代中国产药物作为第一步的任务重点,首先是唯一来源于中国的原料药的药物,其次是国防部使用率高,中国原料药占很大比例的药物。
05
此次事件预期影响
针对不久前的药明康德事件,中国生物技术和制药企业尚且还可以对现有的国际化战略进行审视和调整:一方面更为积极地参与国际标准的制定,通过与国际组织、监管机构的合作,为中国企业在全球市场的发展争取更有利的条件;另一方面,加强与国际同行的交流与合作,提升企业间的学习和创新能力,以促进产业的整体发展水平。也就是说将希望寄托于成长为另一个“华为”,拥有更多属于自己的创新技术,服务引领中国的药械产业从基础研发、知识产权保护、成果转化、市场开拓到支付体系等重要支撑环节都在国际标准下成长起来。
而这次基于国籍的供应链大洗牌——中国不乏经过FDA认证的制药企业,仍逃不过来自政治方面的考量——则跳出了上述逻辑,将出海美国企业的未来发展打上了大大的问号。虽然这项保证美国药品供应链“安全”的举措是否会从军队层面扩大到民众层面还待观察,但是在如今的地缘政治下,事件未来的发展无疑将对那些出海药物尤其是国内原料药生产商产生巨大的不可预知因素。
参考资料:
1.2024.03.18 Letter to DoD about Implementation of Pharmaceutical Supply Chain Measures
2.FY23 NDAA sec 860 Risk management for DoD Pharmceuticals1
本文转载自BIG生物创新社
免责声明
本文系转载,仅做分享之用,不代表平台观点。图片、文章、字体等版权均属于原作者所有,如有侵权请告知,我们会及时处理。
------------------------------
「长按」二维码添加小达「进群」
与更多行业伙伴共探市场前沿资讯
艾美达医药咨询
艾美达(北京)医药信息咨询有限公司,成立于2014年4月,是一家专业的医药行业咨询服务提供商。公司致力于将产业政策研究与真实世界的数据挖掘深度结合,洞悉行业政策对市场的影响,通过专业的研究提供前瞻性的市场分析,为企业产品上市后的市场准入提供整体解决方案