(报告出品方:安信证券)
1. 生命科学研究工具库,黄金赛道“卖水人”
生命科学服务下游用途广泛,同时覆盖科研客户和工业客户。从下游客户来看,生命科学服 务同时覆盖科研客户和工业客户:(1)科研客户是指从事基础科学研究的高等院校和科研院 所,包括但不限于分子生物学、细胞生物学、生物工程、制药工程、遗传学、基础医学、生 物医学工程等研究方向,一般以课题组为单位进行采购。(2)工业客户是指从事生命科学研 究的各类企业,包括但不限于抗体药物研发企业、细胞/基因治疗企业、疫苗企业、体外诊断 企业等,产品应用覆盖从研发到生产的各个环节。在上一篇生命科学服务图谱报告中,我们 基于产品维度,从科研试剂、实验耗材、仪器设备、综合服务等方面全面解读了生命科学服 务涉及到的产品及品牌。本篇报告我们将基于应用维度,重点聚焦企业客户需求,重新对生 命科学服务行业进行解读,全面展现生命科学产业链“卖水人”的风采。
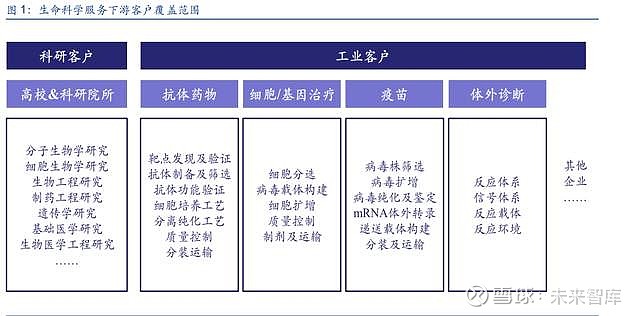
2. 抗体药物:分为研发端和生产端,关注自主可控
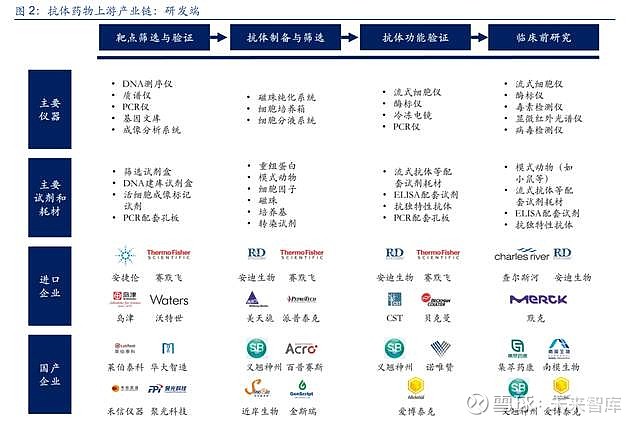
2.1. 抗体药物研发端
近年来单克隆抗体药物得到快速发展,根据 Frost & Sullivan,2020 年中国单克隆抗体市场 规模为 411 亿元人民币,预计到 2025 年市场规模将达到 1,945 亿元人民币,2020-2025 年 的年复合增长率达到 36.5%。抗体药物的研发,需要经历靶点筛选与验证、抗体制备与筛选、 抗体功能验证、临床前研究等阶段,涉及大量仪器设备、试剂及耗材的使用。
(1)靶点筛选与验证:抗体药物开发的起点,尤其是新靶点的发现需要更多的探索性工作, 通过结合基因测序、质谱分析、成像分析等手段,筛选出具有开发潜力的创新靶点。该过程 主要涉及 DNA 测序仪、质谱仪等大型分析仪器的使用,同时在检测过程中需要使用配套的 试剂和耗材。
(2)抗体制备及筛选:根据技术路径的不同,抗体的制备可以分为杂交瘤细胞、转基因小 鼠、单 B 细胞克隆、噬菌体展示等方法,抗体的筛选主要通过磁珠分选的方式进行。在实验 过程中,靶点蛋白(重组蛋白)是刺激宿主生成抗体的重要原材料,磁珠是筛选抗体的重要 原材料,得到广泛使用。此外用于细胞培养的培养基、细胞因子、细胞培养箱等使用也较为 频繁。
(3)抗体功能验证:筛选出来的单克隆抗体需要进行理化性质、免疫学特性、效应作用等 指标的检测,从而评估目标单克隆的功能作用。该过程既涉及到流式细胞仪、酶标仪、PCR 仪等仪器设备的使用,也会涉及到流式抗体、ELISA 试剂盒、抗独特性抗体等试剂耗材的使 用。
(4)临床前研究:开展临床试验之前,还需要对单克隆抗体进行 PK(药代动力学)、PD(药 效动力学)等临床前的分析研究,这个阶段已经开始进行小试阶段的生产,同时需要开展动 物学试验。该过程主要涉及流式细胞仪、酶标仪、毒素检测仪等仪器设备,同时需要使用模 式动物、流式抗体、ELISA 试剂盒等试剂耗材。
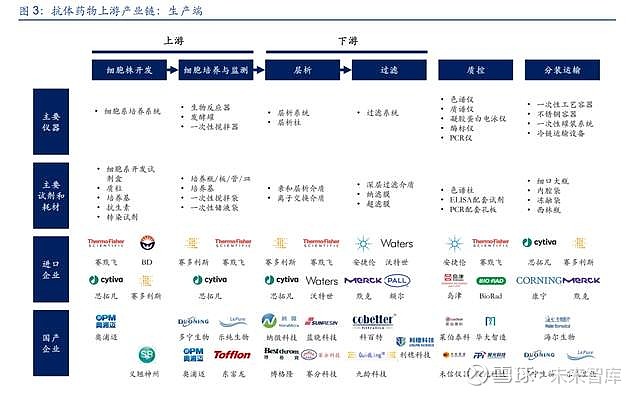
2.2. 抗体药物生产端
抗体药物的生产,分为上游工艺和下游工艺两个部分,其中上游工艺包括细胞株开发、细胞 培养与监测等,下游工艺包括层析、过滤等分离纯化过程,此外后续还需要进行质量控制、 分装运输等环节。根据纳微科技招股说明书,单克隆抗体生产中,上游细胞培养成本占生产 成本的 35%左右,下游分离纯化成本占生产成本的 65%左右,其中培养基、一次性反应袋、 层析填料、滤膜等消耗性原料用量最大,是影响生产成本的关键材料。
(1)细胞株开发:CHO 细胞具有人源化、传代效率高等优势,目前大部分抗体药物选择 CHO 细胞作为表达载体,因此开发出具有高表达能力的稳定细胞株至关重要。该过程主要 涉及实验室条件下的细胞培养和细胞筛选,因此主要使用培养基、细胞系开发试剂盒、细胞 系培养系统等工具。
(2)细胞培养与监测:细胞培养环节是抗体药的核心生产工艺,根据生产规模的要求使用 不同型号的生物反应器。一次性工艺是行业发展趋势,因此涉及到一次性搅拌袋、一次性储 液袋等关键耗材,此外伴随产能的提升,对于培养基等关键原材料的消耗存在明显放大效应。
(3)层析:根据反应原理的不同,抗体药物的层析主要涉及亲和层析、阳离子交换层析、 阴离子交换层析等环节,因此主要涉及 Protein-A 亲和层析介质、离子交换层析介质等关键 层析填料,同时根据产能要求提供层析系统的定制。
(4)过滤:抗体药物的过滤主要包括深层过滤、纳滤(NF)、超滤或渗滤(UF/DF)等环节, 因此主要涉及各类过滤系统及滤膜的使用,其中深层过滤通常使用纤维、滤纸等过滤介质, 主要用于预过滤,纳滤主要用于病毒的清除,超滤主要用于单抗药物的浓缩。
(5)质控:每批次单克隆抗体药物生产完成后,均需要进行相关的质量控制(QC),主要 涉及抗体活性等指标的检测,该过程主要涉及质谱仪、色谱仪、PCR 仪等大型分析仪器的使 用,同时在检测过程中需要使用配套的试剂和耗材。(报告来源:未来智库)
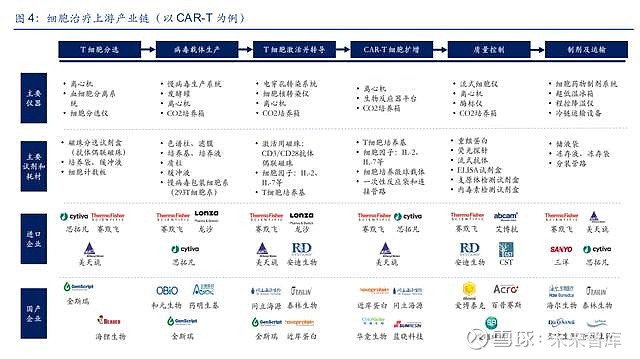
3. 细胞/基因治疗:研发生产一体化,试剂耗材需求旺盛
3.1. 细胞治疗上游产业链
细胞治疗是指通过改造患者自体细胞进行治疗的方法,由于需要针对不同患者进行定制化开 发,因此具有研发生产一体化的特点。根据 Frost & Sullivan,预计中国细胞治疗市场规模将 从 2021 年的 13 亿元增长至 2030 年的 584 亿元,复合增长率达到 53%。以 CAR-T 细胞疗 法为例,核心工艺流程包括 T 细胞分选、病毒载体生产、T 细胞激活并转导、CAR-T 细胞扩 增、质量控制、制剂及运输等环节。定制化的属性导致 CAR-T 的生产成本非常高,参考文 献《Cancer Therapy and Prevention》,目前每例 CAR-T 治疗的可变成本达到 46,397 美元, 其中主要涉及病毒、磁珠、一次性管路、细胞因子、培养基等关键试剂耗材。
(1)T 细胞分选:细胞疗法需要首选从患者体内采集外周血并进行分离,再通过磁珠分选的 方式筛选出目标 T 细胞,自动化、封闭式的细胞分选系统是行业发展方向,决定分选结果的 关键耗材是具有磁性分离作用的分选磁珠。
(2)病毒载体生产:CAR 基因的转导技术包括病毒载体转染和电穿孔转染,如果选择病毒 载体的转染方式,企业需要具备 GMP 级别的病毒生产能力,或者通过 CDMO 企业进行外包 生产。其中慢病毒的应用最为广泛,无血清悬浮培养工艺是行业发展趋势,培养基和质粒是 关键原材料。
(3)T 细胞激活并转导:通过 CD3/CD28 抗体偶联磁珠可以对目标 T 细胞进行激活,然后 利用生产好的病毒载体或者电穿孔转染系统进行 CAR 基因转导,细胞培养箱、T 细胞培养 基和细胞因子扮演重要角色。
(4)CAR-T细胞扩增:转染得到的CAR-T 细胞需要进行大规模的体外扩增,培养基为CAR-T 细胞提供合适的生长环境,细胞因子可以刺激细胞生长及分化,细胞培养微球载体可以提升 培养效率,一次性反应袋及连接导管使用后可以直接更换。
(5)质量控制:扩增后的 CAR-T 细胞需要进行 CAR 分子表达鉴定、T 细胞亚型鉴定、T 细胞功能鉴定、内毒素含量等检测,主要涉及重组蛋白、荧光探针、流式抗体、ELISA 试剂 盒等生物试剂的使用。
3.2. 基因治疗上游产业链
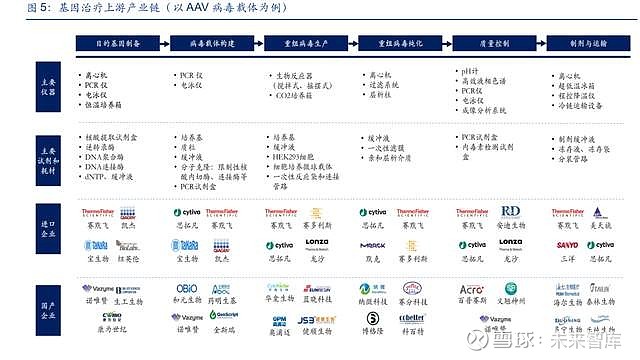
基因治疗是指将外源基因通过病毒载体递送至体内,进而解决基因缺陷问题的治疗方式。根 据 Frost & Sullivan,预计中国基因治疗市场规模将从 2021 年的 2.68 亿元增长至 2025 年的 179 亿元,年复合增长率达到 276%。以 AAV 病毒载体基因治疗为例,核心工艺路径包括目 的基因制备、病毒载体构建、重组病毒生产、重组病毒纯化、质量控制、制剂及运输等环节。
(1)目的基因制备:通常采用逆转录方法,以 RNA 作为模板通过逆转录过程得到 cDNA, 进一步制备目的基因的方式。该过程主要涉及核酸提取试剂盒、逆转录酶、DNA 聚合酶、 DNA 连接酶等分子类生物试剂。
(2)病毒载体构建:目的基因的递送需要腺病毒、腺相关病毒(AAV)、慢病毒、逆转录病 毒等作为载体,其中 AAV 病毒的应用最为广泛,将携带有目的基因的质粒转染天然 AAV 病 毒得到重组 AAV 病毒,需要用到质粒及分子克隆相关的酶。
(3)重组病毒生产:AAV 病毒的生产通常会采用 HEK293 细胞进行培养,由于 HEK293 具 有贴壁生长的特点,经过驯化可以获得具备悬浮生长能力的稳定细胞株,通常会采用无血清 培养基,此外使用微球载体可以加速细胞的生长速度。
(4)重组病毒纯化:科研级别的 AAV 病毒纯化可以采用密度梯度离心的方式,商业化生产 中需要结合层析、过滤等纯化方式,主要涉及亲和层析介质、一次性滤膜等专用耗材。
(5)质量控制:纯化得到的 AAV 病毒需要进行安全性、纯度等指标的检测,主要涉及高效 液相色谱、PCR 仪、电泳仪等设备,以及 PCR 试剂盒、内毒素检测试剂盒等生物试剂。
4. 疫苗:不同技术路径存在明显差异,新技术孕育新机遇
4.1. 传统疫苗上游产业链
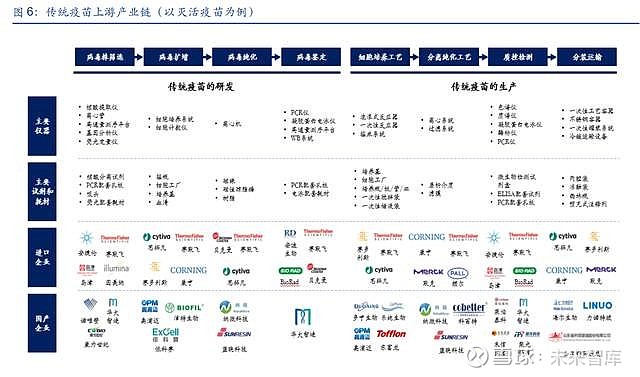
近年来疫苗行业得到快速发展,根据灼识咨询,中国疫苗市场规模由 2015 年的 251 亿元增 长至 2020 年的 640 亿元,并预计将于 2030 年进一步增长至 2,071 亿元(COVID-19 疫苗 除外),年复合增长率达到 12.5%。传统疫苗是指采用完整的病原体作为抗原,通过物理或 化学方法处理,使其丧失感染性或毒性,同时保持良好的免疫原性,是最常见的疫苗技术路 径。以灭活疫苗为例,传统疫苗的研发需要经历病毒株筛选、病毒扩增、病毒纯化和病毒鉴 定等阶段,生产阶段需要经历细胞培养工艺、分离纯化工艺、质控检测、分装运输等环节, 涉及大量仪器设备、试剂及耗材的使用。
(1)病毒株筛选:传统疫苗研发的起点工作,通过结合核酸提取、基因测序、基因分析等 手段,筛选出后续符合要求的病毒株。该过程主要涉及到核酸提取仪、高通量测序仪、基因 分析仪、荧光分析仪等大型分析仪器的使用,同时在检测过程中需要使用配套的试剂和耗材。
(2)病毒的扩增:在筛选得到目的病毒株后,需要对该病毒进行扩增培养,该过程需要一 系列培养所需的仪器和试剂耗材,涉及到细胞培养系统、细胞技术仪等仪器和细胞工厂、培 养基、血清等耗材。
(3)病毒的纯化:病毒纯化环节需要对蛋白样品进行脱盐和透析,臵换缓冲液或去除溶液 中的杂质,同时需要一系列蛋白纯化填料,因此涉及到离心机等仪器和磁珠、磁性琼脂糖、 树脂等耗材。
(4)病毒的鉴定:从培养的细胞中分离病毒后,需要采用免疫荧光和分装生物学技术进行 病毒的鉴定,病毒鉴定涉及到病毒核酸和病毒蛋白的检测技术,因此通常需要使用 PCR 仪、 凝胶蛋白电泳仪、高通量测序平台、WB 系统等仪器和配套的耗材。
(5)细胞培养工艺:细胞培养工艺是传统疫苗的核心生产环节,生产过程中需要用到一系 列反应器等,主要包含波浪式反应器、一次性反应器、摇床系统等仪器,同时还有培养基等 试剂和细胞工厂、一次性搅拌袋、一次性储液袋和细胞瓶等耗材。
(6)分离纯化工艺:层析填料广泛应用于疫苗下游工艺中,以满足高性能,高通量及稳定 的工业级分离纯化产品要求,涉及离心系统和过滤系统等仪器设备,同时包含层析介质和配 套滤膜等耗材。
(7)质控检测:每批次疫苗药物生产完成后,均需要进行相关的质量控制,主要涉及疫苗 活性等指标的检测,该过程主要涉及质谱仪、色谱仪、PCR 仪、凝胶蛋白电泳仪、酶标仪等 大型分析仪器的使用,同时在检测过程中需要使用配套的试剂和耗材。(报告来源:未来智库)
4.2. 新型疫苗上游产业链
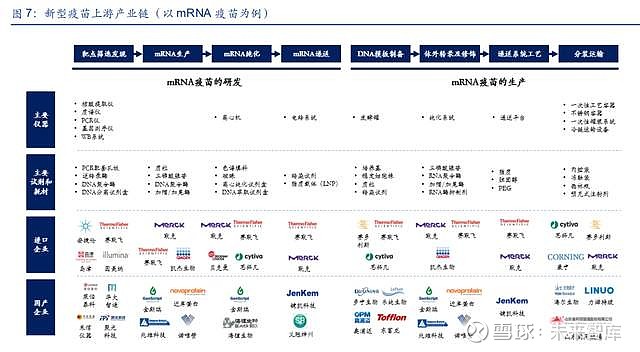
新型疫苗是采用生物化学合成技术、人工变异技术、分子微生物学技术、基因工程技术等现 代生物技术研发生产的疫苗,包含重组蛋白疫苗、病毒载体疫苗、核酸疫苗等。以 mRNA 疫苗为例,研发阶段需要经历靶点筛选发现、mRNA 的生产、mRNA 的纯化、mRNA 的递 送阶段,生产阶段经历 DNA 模板制备、体外转录及修饰、递送系统工艺、分装运输等环节, 涉及大量仪器设备、试剂及耗材的使用。
(1)靶点筛选发现:mRNA 疫苗开发的起点,尤其是新靶点的发现需要更多的探索性工作, 通过结合核酸提取、基因测序、质谱分析等手段,筛选出具有开发潜力的创新靶点。该过程 主要涉及核酸提取仪、质谱仪、PCR 仪、基因测序仪、WB 系统等大型分析仪器的使用,同 时在检测过程中需要使用配套的耗材和逆转录酶、DNA 聚合酶、DNA 分离试剂盒等试剂。
(2)mRNA 生产:mRNA 生产主要指体外转录过程,质粒 DNA 在体外通过 RNA 聚合酶转 录得到 mRNA,该过程主要涉及质粒、三磷酸腺苷、DNA 聚合酶、加帽/加尾酶等一系列生 物试剂。
(3)mRNA 纯化:mRNA 纯化主要指去除酶、剩余的核苷酸、质粒 DNA 和有缺陷的 mRNA 等物质。纯化过程主要涉及离心机等仪器,色谱填料和磁珠等耗材和离心纯化试剂盒、DNA 萃取试剂盒等试剂。
(4)mRNA 递送:目前常用的递送技术有电穿孔、阳离子聚合物脂质体等,主要涉及电转 系统等仪器和转染试剂、脂质载体(LNP)等试剂。
(5)DNA 模板制备:DNA 模板的制备主要通过携带目标核酸序列的质粒转染大肠杆菌的方 式进行扩增生产,涉及到的仪器设备有发酵罐,试剂有培养基、稳定细胞株、质粒、转染试 剂等。
(6)体外转录及修饰:首先将质粒线性化处理得到正常的 DNA 模板,再通过酶催化的方式 完成体外转录和体外修饰(加帽和加尾),主要涉及三磷酸腺苷、RNA 聚合酶、加帽/加尾酶、 RNA 酶抑制剂等试剂。
(7)递送系统工艺:目前 mRNA 主要的递送载体为脂质纳米颗粒(LNP),该领域存在比 较明显的专利保护,主要涉及脂质、胆固醇、PEG 等原材料。
5. 体外诊断:重点关注关键原料,新冠刺激进口替代
体外诊断是指通过对血液、体液、组织等样本进行体外检测的诊断方式,根据反应原理,可 以分为生化诊断、免疫诊断、分子诊断。根据医疗器械蓝皮书,中国体外诊断市场规模从 2015 年的 362 亿元增长至 2019 年的 713 亿元,年复合增长率达到 18.5%。体外诊断的上游原料 包括核心反应体系、信号体系、反应环境、反应载体,其中核心反应体系决定检测的灵敏度 和特异性,信号体系影响检测结果的可视程度,反应环境和反应载体可以保障反应顺利进行。 根据菲鹏生物招股说明书,体外诊断整个上游的市场规模约占诊断试剂和仪器出厂口径的 25% 左右,约占整个终端市场的 10%左右。
(1)核心反应体系:生化诊断的反应体系主要包括化学试剂、抗原、抗体、诊断酶等试剂; 免疫诊断的反应体系主要包括抗原、抗体、标记酶等试剂;分子诊断的反应体系主要包括引 物、dNTP、分子诊断酶、DNA 建库相关酶等试剂。
(2)信号体系:生化诊断的信号体系主要是反应本身产生的有色物质;免疫诊断的信号体 系包括酶底物系统、化学发光剂、胶体金、量子点等发光物质;分子诊断的信号体系包括荧 光探针、荧光染料、荧光标记 dNTP 等。
(3)反应环境:生化诊断的反应环境主要是抗原抗体、酶所需生物缓冲溶液;免疫诊断的 反应环境包括抗原抗体、酶所需生物缓冲溶液或者牛血清蛋白稀释液等;分子诊断的反应环 境包括 PCR 缓冲液、杂交缓冲液、文库稀释缓冲液等。
(4)反应载体:生化诊断的反应载体包括普通溶液和胶乳微球;免疫诊断的反应载体包括 酶标板、磁性微球、NC 膜、荧光微球、量子点荧光微球等;分子诊断的反应载体包括核酸 提取微球、基因芯片载体、测序磁性微球等。

(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)
详见报告原文。
精选报告来源:【未来智库】。