如需原文档,请登陆未来智库www.vzkoo.com,搜索下载。
1. 疫苗技术发展即将迎来第三次革命
疫苗是将病原微生物及其遗传物质或代谢产物,经过人工减毒、灭活或利用转基因 等方法制成的用于预防传染病的生物制剂。暴露于此类病原体会诱导产生具有病原 体特异性的免疫细胞,从而使人体长时间保留免疫记忆。
疫苗的发现在人类历史长河中具有里程碑式的意义,曾夺走数亿人生命的天花病毒 在牛痘疫苗出现后便被彻底消灭,之后的两百多年中针对狂犬病、结核、小儿麻痹 症等几十种传染性疾病的疫苗也被相继发现。
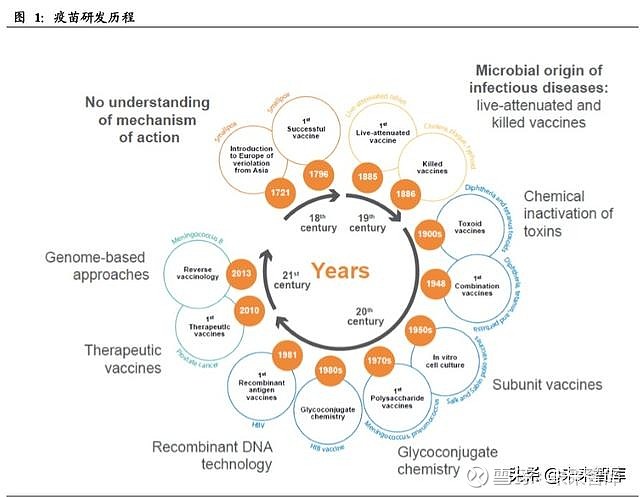
世界上第一支疫苗诞生于 1796 年,英国医生爱德华〃詹纳成功地用“牛痘”病灶 的渗出液接种了一个 8 岁男孩,开创了人工主动免疫的先河。大约一个世纪后,随 着对微生物感染机理的进一步研究,法国化学家路易斯〃巴斯德通过使人们接触减 毒或灭活的微生物而率先开发了第一代疫苗技术。
减毒疫苗(Live‐attenuated vaccine)是指病原体经过甲醛处理后,毒性亚单位的结 构改变,毒性减弱,结合亚单位的活性保持不变,依然保持了抗原性的疫苗。减毒 活疫苗接种后不会引起疾病的发生,但病原体可以引发机体免疫反应,刺激机体产生特异性的记忆 B细胞和记忆 T 细胞,起到获得长期或终生保护的作用。这类疫苗 的优势在于诱导产生的抗原数量、性质和位臵均与天然感染相似,因此免疫力强、 作用时间长。但对于儿童及老年人等免疫力较差的接种者,有一定可能发生突变并 恢复毒力,存在潜在的致病危险。
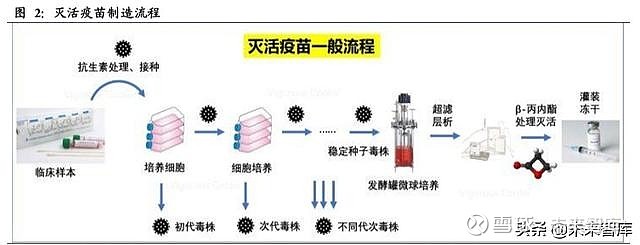
灭活疫苗(Killed vaccines)是指先对病毒或细菌抗原进行培养,然后用加热或化学 剂将其灭活所制成的疫苗。灭活疫苗可以由整个病毒或细菌组成,也可由它们的裂 解片段组成为裂解疫苗。与减毒疫苗相比,灭活疫苗采用的是非复制性抗原,因此 安全性好,但同时也牺牲了一定的免疫原性,通常需要加强免疫。
上世纪 70 年代, “糖结合”这一至关重要的疫苗开发技术得以发现,即将细菌不具 有足够免疫原性的多糖外壳与蛋白质相连,从而大大增强了免疫反应。这项技术也 被广泛应用于 B型流感嗜血杆菌(Hib)疫苗和肺炎球菌(PCV)疫苗。
随着分子生物学技术的发展,疫苗模拟病原体的方式得到进一步的丰富,亚单位疫 苗和重组疫苗应运而生。亚单位疫苗是通过化学分解或有控制性的蛋白质水解方法 使天然蛋白质分离,提取细菌、病毒的特殊蛋白质结构,筛选出具有免疫活性的片 段制成的疫苗。
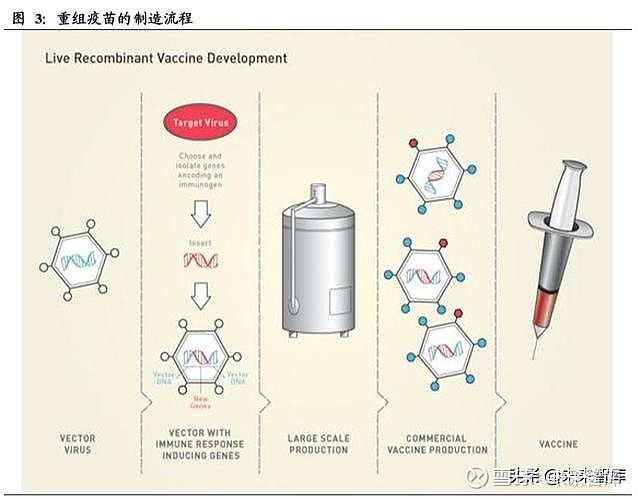
重组疫苗(Recombinant vaccine)是利用基因工程技术,将病原体能诱发机体免疫 应答的蛋白质对应的 DNA 插入细菌、酵母或哺乳动物细胞中,经表达、纯化后而 制得的疫苗。与减毒/灭活疫苗相比,第二代疫苗的副作用以及引起相关疾病感染的 风险进一步降低。目前应用较为广泛的乙肝疫苗(HepB)和宫颈癌疫苗(HPV)就 是第二代疫苗的成功典范。
核酸疫苗(Nucleic acid vaccine),又称基因疫苗(Genetic vaccine), 是最近几十年 从基因治疗研究领域发展起来的一种全新的疫苗技术。其将抗原蛋白对应的 DNA 或 mRNA序列直接导入被接种者细胞,通过宿主细胞的转录系统转录并翻译成抗原 蛋白,诱导宿主产生对该抗原蛋白的免疫应答,从而使被接种者获得相应的免疫保 护。
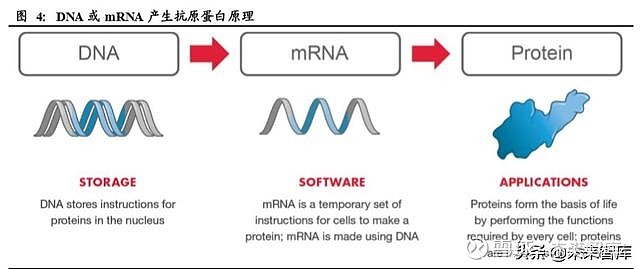
核酸疫苗通常包含一个能在哺乳细胞高效表达的强启动子元件例如人巨细胞病毒 的中早期启动子;同时也需含有一个合适的 mRNA 转录终止序列。肌内注射后, DNA 进入胞浆,然后到达肌细胞核,但并不整合到基因组。
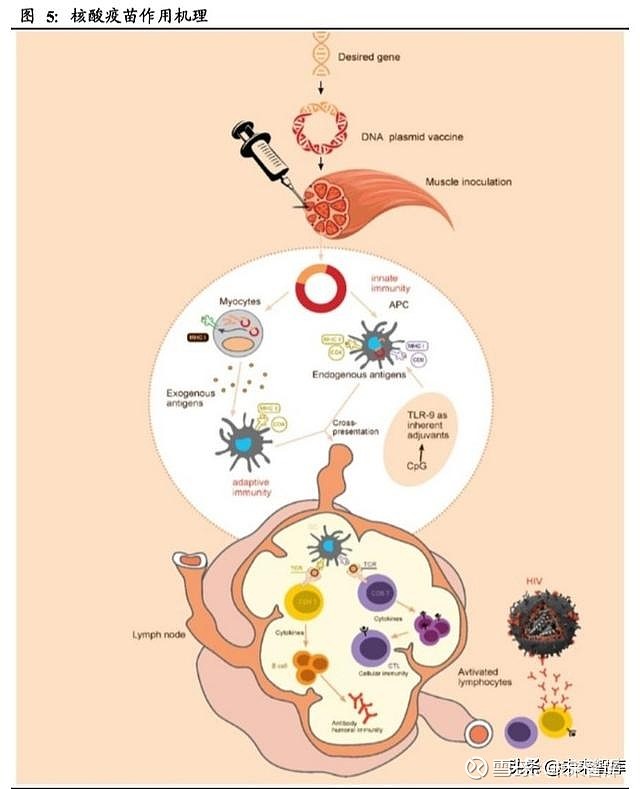
宿主细胞内产生的抗原蛋白会被抗原提呈细胞(APC)识别并分解为由若干个氨基 酸组成的多肽片段,并将这些片段与不同类型的 MHC 复合体相结合并呈递。MHC-I 类复合体结合 CD8+型 T 细胞(CTL),促进 CTL 释放穿孔素和颗粒酶将表达外源 蛋白的细胞杀死,形成细胞免疫。MHC-II 类复合体结合 CD4+型 T 细胞,CD4+型 T 细胞会进一步结合并激活 B细胞合成相应的抗体,形成体液免疫。
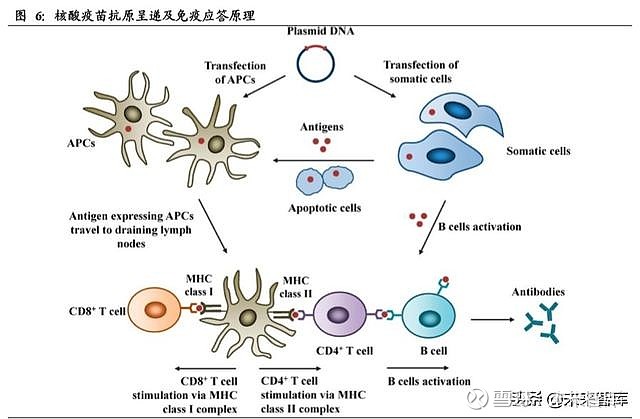
与传统疫苗相比,核酸疫苗特殊的免疫机制也带来了许多优点:
抗原自然性:核酸疫苗诱导的免疫反应与病毒自然感染所产生的免疫应答相似度极 高,由于 DNA 或 mRNA在接种者体内转录和表达产生内生抗原,因此能够克服蛋 白亚基疫苗在体外利用工程菌合成时易发生错误折叠和糖基化不完全等问题。
表位广谱性:与传统疫苗相比,核酸疫苗接种后在宿主细胞内表达抗原蛋白,直接 与抗原呈递复合体结合,同时引起细胞免疫和体液免疫,因此诱导产生的抗原特异 性免疫反应具有广谱性。由于 CTL 应答也是机体杀死癌变细胞的有效清除途径,因 此核酸疫苗在技术上能够对非病毒诱导的癌症进行预防。
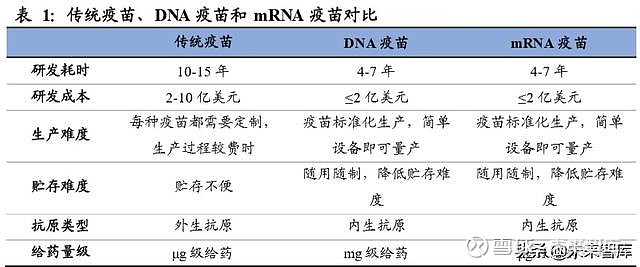
生产和贮存便利:核酸疫苗通常只需要构建高效的表达质粒在细菌中生产,与传统 疫苗相比省去了抗原提取和纯化等成本较高的工艺流程,生产成本低廉。DNA 稳定 性好,大量变异的可能性较低,利于质量控制。加工完成的 DNA 疫苗可以干燥加 工成微粒,在室温下也能够稳定的储存和运输。
给药量级低:核酸疫苗抗原合成稳定性良好,能够在接种者体内长期储存并持续诱 导免疫应答,因此能够减少加强注射的剂量,毫克或微克级的核酸片段就能够活化 细胞毒性 T 细胞。
2. 三大应用领域核酸疫苗优势明显
2.1. 急性传染病
回顾本次海内外新冠疫情的发展情况,不难发现从最初报告零星确诊病例到全球性 的爆发耗时仅月余,并且由于尚无明确特效药,仅能通过隔离和限制人员流动的方 式进行管控,对全球生产经济活动造成巨大损失。
事实上,进入 21 世纪后全球范围内已经多次出现急性传染病疫情,其中非典型肺 炎和中东呼吸综合征与新冠相似,同为冠状病毒引起,但由于疫情在短时间内爆发 后迅速结束,因此没有完成商用疫苗的开发,只有 Innovio 公司针对 MERS 的 DNA 疫苗 GLS-5300 完成了 I 期临床试验。
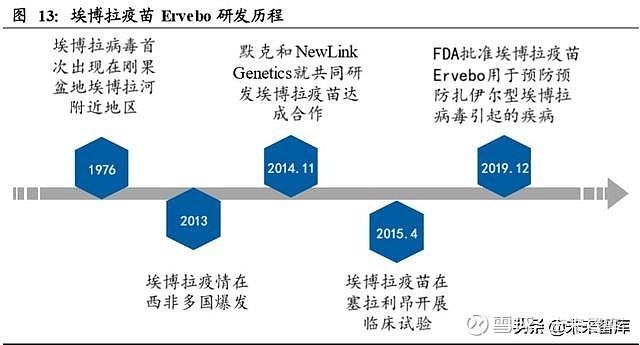
埃博拉病毒最早于 1976 年在西非刚果盆地埃博拉河流域发现,在 2014 年和 2018 年非洲地区又出现过两次疫情大爆发。目前,全球共有两款获批的埃博拉疫苗,分 别是默克公司 2019 年在 FDA 和 EMA 获批上市的 Ervebo 以及康希诺 2017 年在国 内获批并作为国家应急储备的重组埃博拉疫苗。从埃博拉病毒首次被发现到疫苗研 发成功,共经历了 40 余年时间。
一款新疫苗的研发流程通常需要经历药物发现、临床前试验以及 I-III 期临床试验以 验证其安全性和统计学意义上的有效性,整个流程在一切顺利的情况下也要花费 5-10 年时间。
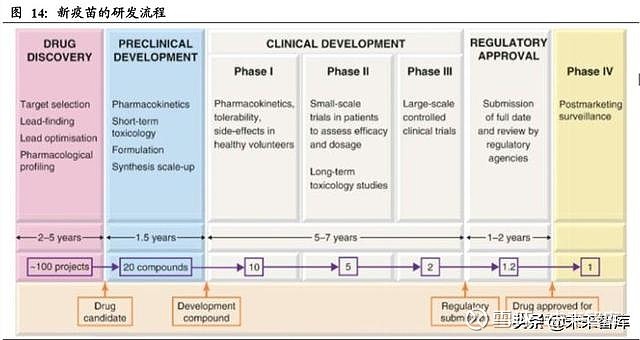
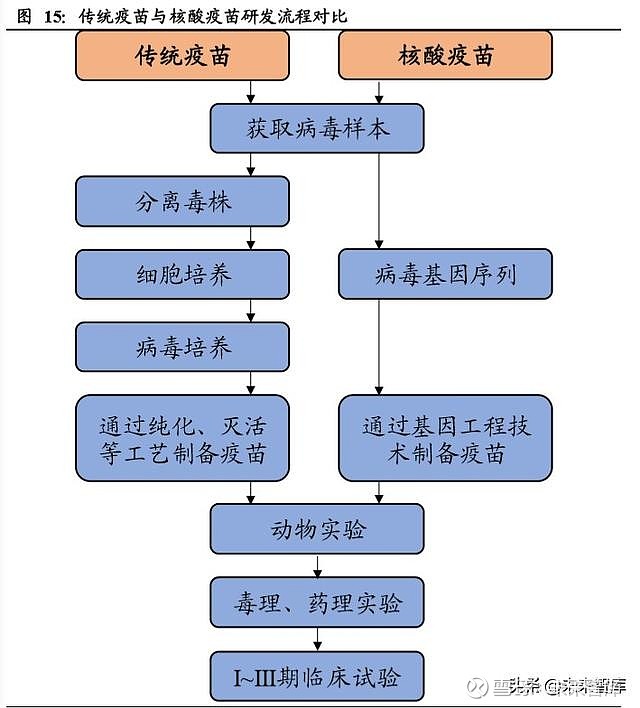
传统疫苗的研发流程首先需要筛选毒株,找到能代表病毒抗原特征的病毒;接着通 过在体外通过鸡胚或者细胞培养病毒,作为以后大规模生产疫苗的种子病毒。并通 过纯化、灭活等工艺制备候选疫苗。采用传统的野生病毒株减毒、灭活的办法筛选 验证一个低毒而有免疫原性的毒株,最快也需要 3-6 个月时间。而核酸疫苗并不需 要分离毒株,在获得病毒基因序列后便可以直接体外合成,因此可以省去病毒分离、 培养以及纯化、灭活等一系列流程,最大限度的压缩药物发现阶段所耗费的时间。
根据美国生物科技公司 Moderna 披露,其新冠疫苗的研发工作开始于 1 月 11 日, 在这一天中国科学家向全球公布了新型冠状病毒的基因序列,正是基于这一数据 Moderna 的研究团队启动了病毒表面的核心蛋白序列的筛选。2 月 24 日,针对新冠 病毒的疫苗 mRNA-1273 研制成功并送往美国国家过敏和传染病研究所(NIAID) 开启安全性临床试验。3 月 16 日,新冠疫苗 mRNA-1273 对首位临床试验参与者完 成首次给药,从药物发现到进行临床试验仅耗时 2 个月。
根据世界卫生组织 3 月 20 日公布的新冠候选疫苗情况,全球共有 2 款候选疫苗进 入临床 I 期阶段,分别是 Moderna的 mRNA 疫苗以及康希诺的病毒载体疫苗。在所有已公布技术平台和抗原类型的候选疫苗中,共有 10 款产品选择了核酸疫苗的技 术路线,数量上与病毒载体平台以及蛋白疫苗平台相似。根据 BioNTech 和 Innovio 此前公布的消息,其新冠疫苗产品最快能够在 4 月启动临床试验。
2.2. HIV
在过去的 20 年中,艾滋病毒一直是全球人类健康的主要危害之一,特别是在低收 入国家。目前尚未有完全治愈 HIV患者的方法,只能以鸡尾酒疗法或服用抗反转录 病毒药物(antiretroviral therapy)减缓病情发作,并藉此延长病患寿命。根据联合国 艾滋病规划署的数据,2018 年有超过 7.7 万人死于艾滋病毒感染,艾滋病已经成为 严重危害人类健康的公共卫生问题。
事实上,目前对 HIV病毒的研究已经非常充分,已知艾滋病毒毒株共有 M、N、O、 P 等 4 种类型,每种各有不同源头。病毒直径 120 纳米,是一种大的包膜病毒,病 毒外覆盖着来自宿主细胞的双层类脂包膜,包膜镶嵌有 gp120 与 gp41 蛋白共同组 成的包膜突刺(Envelope spike protein),突刺能够和 T 细胞的 CD4 蛋白结合介导入 侵人体细胞。
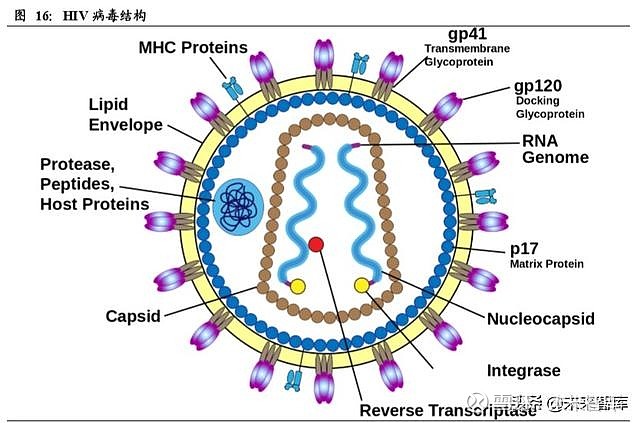
因此位于突刺蛋白最外侧的 gp120 也就成为了疫苗诱导出抗体最佳的靶点。然而, HIV病毒突刺蛋白的糖基化程度很高,并且由于糖蛋白缺乏共价键连接而容易分裂。 这样的结构使得 HIV 病毒在人类免疫系统中显得格外的不显眼,注射灭活的 HIV 疫苗根本无法产生抗体。另一方面,HIV拥有攻击 T 细胞的能力,传统的减毒活疫 苗会导致严重的感染,并且一旦 HIV病毒逆转录完成,机体便再无法彻底清除掉这 种病毒。
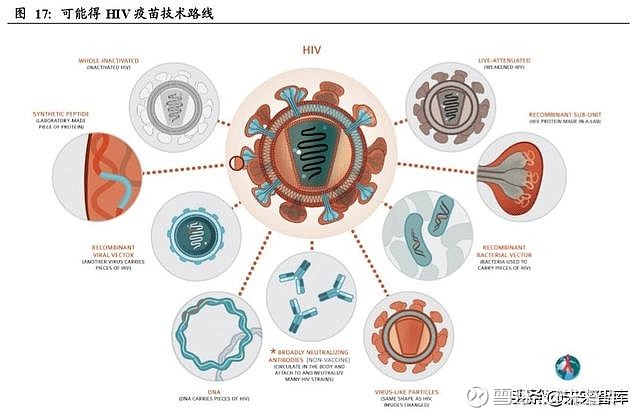
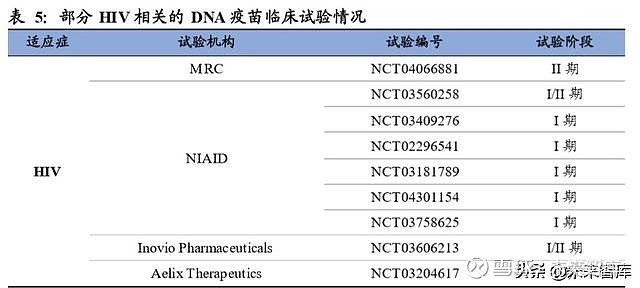
自艾滋病出现以来,开发有效的艾滋病疫苗便是科学界不懈追求的目标之一,但其 进展一直比较缓慢。近 20 年来在 NIH(美国国立卫生研究院)以及其他众多机构 的支持下,在全球范围内开展了多次大型 HIV疫苗临床试验,疫苗类型包括蛋白抗 原、腺病毒载体疫苗以及混合使用等诸多方案,但均收效甚微,即使是最有希望的 RV144 疫苗也在后续的临床试验被证明从统计学意义上无效。
目前推进至临床试验的核酸疫苗其设计大多基于 HIV 病毒非转录片段对应的基因 序列,但有报告显示 HIV 的 DNA疫苗在单独使用时免疫原性并不高,因此多种类 型疫苗组合使用是较为可能的一种形式。2019 年在美国开展的 HVTN 105 研究中, DNA 疫苗(DNA-HIV-PT123)和蛋白疫苗(AIDSVAX B/E)的组合方案就能够诱 导出高强度且持久的结合抗体反应,以及更快速的潜在保护性免疫反应。
2.3. 癌症预防
常规疫苗的有效性体现在诱导产生中和抗体,但更主要的是病毒蛋白质在感染细胞 中的重新合成并降解产生的多肽产物与 CD8+前体细胞的相互作用,激活并导致 CD8+毒性 T 细胞克隆的产生。这种方法可以预防病毒以及由病毒诱导产生的人类 肿瘤,如利用 HPV 疫苗预防宫颈癌,但大多数的人类癌症并非由病毒引发,因此 癌症疫苗的研发需要一条全新的技术路径。
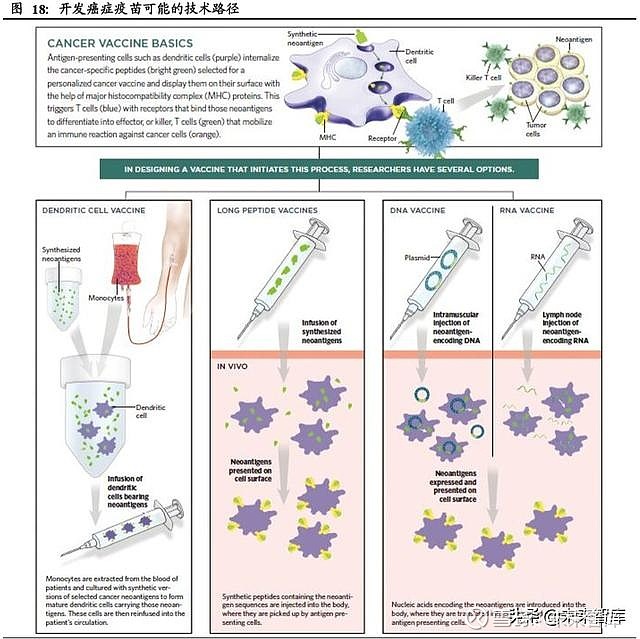
目前进展较快的 DC 疫苗是一种治疗性癌症疫苗,其原理是利用疫苗刺激免疫系统 中的树状细胞(Dendritic Cell),当树状细胞在细胞表面呈现出肿瘤抗原后,能够直 接诱导细胞杀伤性 T 细胞对特定癌细胞进行清除。
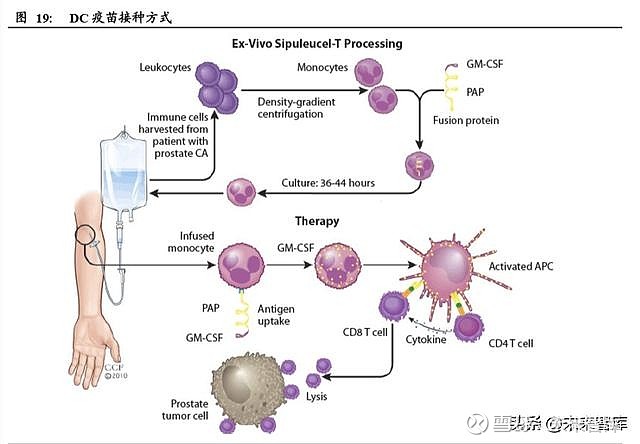
DC 细胞在体内含量很低且不能够增殖,所以在临床使用时必须从患者的前体细胞 开始进行体外培养,整个流程较为繁琐导致治疗费用较高。目前被 FDA 批准用于 临床应用的免疫细胞疫苗只有美国 Dendroen 公司的自体 DC 疫苗 PROVENGE,适 应症为晚期前列腺癌。
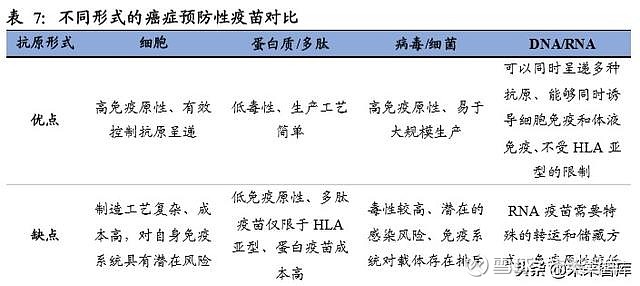
通过对 ClinicalTrials 中的临床试验记录按照关键词整理,当前正在进行中的 DNA 疫苗临床试验有 35.3%是关于癌症的。在这些癌症相关的临床试验中,宫颈癌占 31%,前列腺癌占 24%,乳腺癌占 15%,除此之外还有胶质母细胞瘤、胰腺癌和卵巢癌等多个适应症的研究。
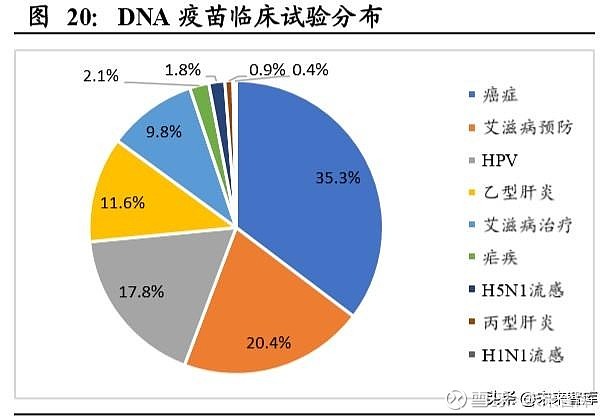
早在 1998 年 FDA 便首次批准了用于人类肿瘤治疗 DNA 疫苗的临床试验,在过去 20 多年的研究中,DNA 疫苗的总体安全性已得到充分证明,基本没有观察到针对 DNA 疫苗原核部分本身的抗体反应。目前 Inovio 公司针对宫颈癌的 DNA 疫苗进度 较快已经进入了 III 期临床。此外,宫颈癌、卵巢癌、前列腺癌等适应症均有相关 DNA 疫苗正在进行 II 期临床试验。
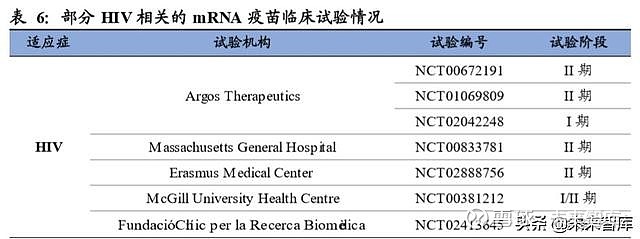
与 DNA 疫苗相比,RNA疫苗不需要进入细胞核就可以表达抗原蛋白,相对来说效 率更高,并且停留在细胞质内的 mRNA 不会对细胞基因组产生影响,因此安全性更 高。但 mRNA 稳定性较差,裸露的 mRNA 在进入细胞前就会大量降解,近几年随 着纳米脂质体递送等技术的发展,mRNA疫苗的研发也在逐步提速。
目前癌症 mRNA疫苗的相关临床研究已涵盖转移性前列腺癌、肺癌、肾细胞癌、脑 癌、黑色素瘤、急性髓性白血病和胰腺癌等。
3. 海外核酸疫苗独角兽
3.1. Moderna
Moderna Therapeutics 成立于 2010 年,总部位于美国马萨诸塞州,主要创始人Derrick Rossi 及其团队来自哈佛大学,曾发现 RNA 诱导的多能干细胞技术。公司以开发人 类蛋白质以及抗体药物为核心,致力于通过 mRNA疗法,治疗传染病、癌症、罕见 病、心血管等疾病。
公司在不到十年的时间里通过风险投资和 IPO 等方式获得了超过 20 亿美元的资金 用于研发和开展药物临床试验。另一方面,Moderna 公司积极寻求外部合作,与阿 斯利康、默克、Vertex 等国际医药巨头共同开发新型 RNA药物。
Moderna 公司目前拥有 Valera、 Onkaido、 Caperna 和 Elpidera 四个研发平台,分 别在感染性疾病、肿瘤免疫治疗、个性化肿瘤疫苗和罕见病领域开发 mRNA药物。 公司目前有 21 款在研药物,其中 13 种已经进入临床阶段。

3.2. BioNTech
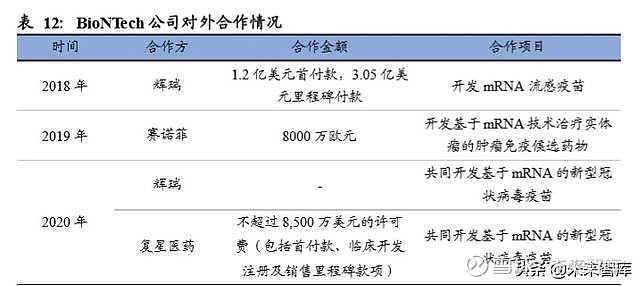
BioNTech 成立于 2008 年,总部位于德国慕尼黑,是目前欧洲规模最大、发展最快 的生物技术公司之一。公司拥有 mRNA 疗法、细胞与基因疗法、蛋白质疗法和小分 子疗法等四个药物研发平台。近年来,BioNTech 与辉瑞和赛诺菲等国际医药巨头就 mRNA疫苗药物达成长期合作。2020 年 3 月,复星医药宣布与 BioNTech 共同开发 并商业化一款基于 mRNA 技术的新型冠状病毒疫苗。
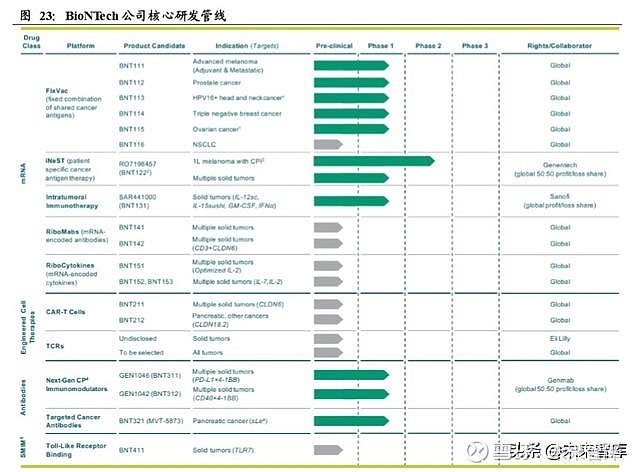
BioNTech 的主要研发方向集中在 mRNA 肿瘤治疗性疫苗,同时也兼顾 CAR-T 细胞治疗、双特异抗体及小分子药物项目。BioNTech 在肿瘤疫苗方面有 FixVAC、 RNA-Warehouse 以及 IVAC-Mutanome 三个 mRNA药物平台。
3.3. CureVac
CureVac 创立于 2000 年,总部位于德国图宾根,成立至今一直专注于 RNA药物的 研发。公司拥有 RNActive、RNAntigen、RNArt、RNAntibody 和 RNAdjuvant 等多 个药物开发平台,研发管线覆盖癌症免疫疗法、抗体疗法、治疗罕见疾病的分子疗 法和预防性疫苗等。
3.4. Inovio
Inovio 的前身是 Viral Genomix,2006 年更名为 VGX Pharmaceuticals。2009 年 6 月 VGX 与专注研发电穿孔技术的公司 Inovio Biomedical Corporation 合并,合并后的公 司即现在的 Inovio Pharmaceuticals。
基于新型 DNA 疫苗的合成设计平台 SynCon 以及电穿孔运载系统 CELLECTRA, Inovio 拥有针对 HIV、中东呼吸综合征(MERS)以及埃博拉病毒等多个产品。其 中,MERS-CoV疫苗 INO-4700 在 2016 年开展的I 期临床试验中展现出良好的耐受 性,在大约 95%的受试者中诱导出了高水平的抗体反应,同时在近 90%的受试者中 产生了广泛的 T 细胞应答。

4. 国内企业
4.1. 艾棣维欣
艾棣维欣成立于 2009 年,创始人是复旦大学荣誉教授、中国知名的 DNA 疫苗专家 王宾博士,公司拥有近 40 人的研发团队。公司通过自主研发和外部合作的模式, 在传染性疾病、自身免疫性疾病和癌症等领域广泛布局,目前在研项目包括新型呼 吸道合胞病毒(RSV)疫苗、I 型糖尿病(T1D)治疗性疫苗、乙肝治疗性疫苗等, 其中重磅品种 RSV 疫苗已经在海外启动临床实验。
1 月 30 日, Inovio Pharmaceuticals 宣布将与北京艾棣维欣携手加快在中国开发针对 新型冠状病毒株(2019-nCoV)的疫苗 INO-4800,双方签订合作备忘录。
2 月 4 日,鹏鹞环保发布了《关于签订增资框架协议的公告》,披露公司决定以自有 资金出资 3,000 万元对外投资参股北京艾棣维欣生物技术有限公司,并签署了增资 框架协议,推进艾棣维欣的新冠病毒 DNA疫苗研发。
2 月 9 日,康泰生物发布公告称,为加快新型冠状病毒(2019-nCoV)DNA疫苗的 研发,公司与艾棣维欣(苏州)生物制药有限公司签署了《战略合作协议书》,拟 发挥各自优势,共同致力于研发新冠 DNA 疫苗。
公司目前的在研产品包括新型呼吸道合胞病毒(RSV)疫苗、I 型糖尿病(T1D)治 疗性疫苗、乙肝治疗性疫苗、新型冠状病毒 DNA 疫苗等。呼吸道合胞病毒(RSV) 肺炎疫苗已经在澳大利亚通过了一期临床试验,I 型糖尿病(T1D)治疗性疫苗和乙 肝治疗性疫苗目前已进入临床前阶段。
4.2. 斯微生物
斯微生物于 2016 年在上海张江成立,由美国 MD Anderson 肿瘤中心的博士团队归 国创建。基于 LPP 递送和 mRNA合成两大平台,公司布局 mRNA 个体化癌症疫苗、 mRNA传染病疫苗、蛋白缺陷类疾病 mRNA 药物,以及遗传病 mRNA 药物等。
……
(报告来源:东北证券)
获取报告请登录未来智库www.vzkoo.com。