3月1日,加科思药业宣布其自主研发的p53 Y220C激活剂JAB-30355在美国获批新药临床试验申请(IND),将在美国开展I/IIa期晚期实体瘤临床试验,以评估JAB-30300的安全性及有效性。加科思同时计划在中国提交新药临床申请,获批后将在中美两国同步开展临床试验。目前p53 Y220C激活剂在全球只有一个同类项目即将开展注册性单臂II期临床,这标志着加科思成为全球第二家在p53 Y220C靶点获批临床的公司。
1、p53:首个进入临床的激活剂
p53是一个抑癌基因,被誉为“ 基因组守护者 ”。在应激或者逆境状态下(例如DNA损伤),p53会被激活。p53的激活会促进DNA修复,或促进DNA不能正确修复的细胞发生凋亡,从而阻止癌症的发生和发展。TP53基因突变有多个亚型,存在于约50%的肿瘤病人中。TP53基因突变是癌症发生和进展的重要原因已被发现50年,然而p53至今尚未成药。其中一个重要原因是它不同于原癌基因,是一个抑癌基因,现在所有的肿瘤药都针对原癌基因,抑癌基因和原癌基因天然互补。这一作用机制决定了p53可以和其他疗法产生互补的作用。肿瘤细胞自身有修复功能,如果在化疗或放疗过程中,受伤的肿瘤细胞会通过自身修复功能让细胞活下去。而p53的特殊能力是,对受损的肿瘤细胞进行凋亡,起到清除肿瘤细胞的作用。因此p53能够和化疗、放疗等治疗手段联用。这个项目很有希望成为下一个如K药一般的泛瘤种抗癌药,可以精准治疗带有这一突变的患者。
开发p53激活剂需要恢复它的功能才能杀伤肿瘤。目前所有的肿瘤药都是通过破坏靶点功能从而治疗癌症,通过恢复靶点功能产生治疗作用的案例少之又少。修好一样东西比破坏一样东西困难很多,所以如何恢复p53的功能,成为了癌症治疗中“皇冠上的明珠”。
p53是与RAS、MYC齐名的三大不可成药靶点之一,因为p53蛋白的表面光滑,没有合适的口袋能够与化合物结合,这使得p53很难成药。因此,许多药企选择通过抑制p53与其他蛋白的结合来恢复p53的功能。MDM2是p53的关键负调节因子,能够让P53蛋白维持在低水平。留下来的p53可以继续行使监督功能,杀死那些具有癌变倾向的细胞。因此日后MDM2抑制剂有望与p53联用,起到增强药效的作用。
而此次加科思不同于MDM2的思路,直接选择将p53致癌突变恢复成野生型构象和功能,激活p53的抑癌功能。
研发p53激活剂的排头兵是美国公司PMV,该公司的PC14586是此前唯一进入临床的同靶点项目,II期单臂临床将于2024年在美国启动,并获得FDA的“快速通道资格认定”,日后也将开展p53和PD-1的联用。PC14586是一款first-in-class小分子p53激活剂,旨在选择性地结合P53 Y220C突变蛋白中存在的缝隙,并恢复p53野生型(正常)构象和转录活性,从而产生有效的临床前抗肿瘤活性。从PMV于2023 AACR-NCIEORTC International Conference公布的数据,PC14586单药在RP2D剂量(2000 mg QD)下,在16例既往接受过治疗的实体瘤患者中,总体客观响应率(ORR)为38%(6/16)。这6例患者中,包括卵巢癌,肺癌,乳腺癌,子宫内膜癌。这也说明,p53激活剂在未来很有可能成为一个泛瘤种抗癌药。
目前全球每年新发癌症病例超过1900万,随着人口老龄化加剧,世卫组织预计2050年全球将有3500万癌症病例,由于全球一半的癌症患者都带有p53突变,因此每年能够使用P53激活剂的潜在患者将达到1750万人,市场潜力巨大。带有p53 Y200C突变的患者占所有实体瘤患者的1%,预计每年全球新发携带p53 Y220C的癌症患者10万人以上。加科思将以此为起点开发p53突变的更多亚型,延续其以KRAS G12C抑制剂为出发点布局KRASmulti等更多KRAS靶点产品的策略,使p53激活剂成为又一超大品种。
2、加科思:全球前三项目的“爆款制造机”
加科思目前多个项目研发进度处于全球前三,并且临床数据展示出“同类最佳”潜力。
01 SHP2抑制剂:全球首个进入注册性三期的分子
加科思的SHP2抑制剂以全球第二进入临床,在今年2月宣布SHP2抑制剂JAB-3312与KRAS G12C抑制剂戈来雷塞联合用药治疗1线非小细胞肺癌在中国获批注册性三期临床试验,使得JAB-3312成为全球首个获批进入三期注册性临床的SHP2抑制剂。
根据加科思在2023年ESMO大会公布的数据,戈来雷塞800毫克及2毫克JAB-3312联用治疗1线非小细胞肺癌,客观缓解率为86.7%,疾病控制率为100%,数据显著优于其他对手,从而实现了全球数据和研发进度的“双第一”。

02 KRAS G12C抑制剂:胰腺癌适应症全球唯一进入注册性临床的分子
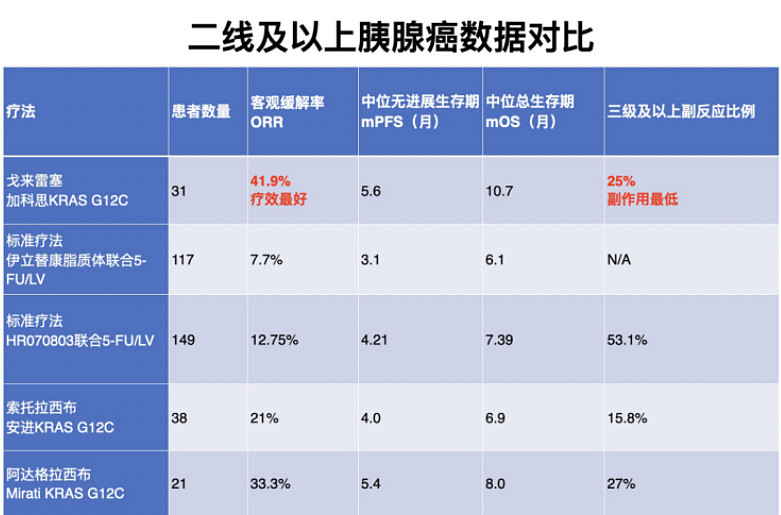
加科思的KRAS G12C抑制剂戈来雷塞是目前全球唯一开展胰腺癌注册性临床试验的同类产品,并且在中国获得突破性疗法认定。目前加科思正在与FDA沟通在美国开展胰腺癌注册性临床试验。太平洋证券指出,戈来雷塞胰腺癌适应症有出海预期。
在二线及以上的胰腺癌患者中,标准疗法是化疗,其ORR约为10%,三级以上副反应超过50%。加科思的戈来雷塞确认客观缓解率为41.9%,且三级以上副反应仅为标准疗法的一半,同样显著优于同类产品。
03 BET抑制剂:活性强,差异化优势明显
加科思的BET抑制剂 JAB-8263是同类临床项目中活性最强的BET抑制剂,有望在极低剂量下有效抑制多种肿瘤生长。德国公司MorphoSys公司的Pelabrisib是进展最快的BET抑制剂,骨髓纤维化适应症有望于2024年在海外获批上市,加科思的JAB-8263凭借高活性有望成为“Best in class”。
04 Aurora A抑制剂:高选择性分子
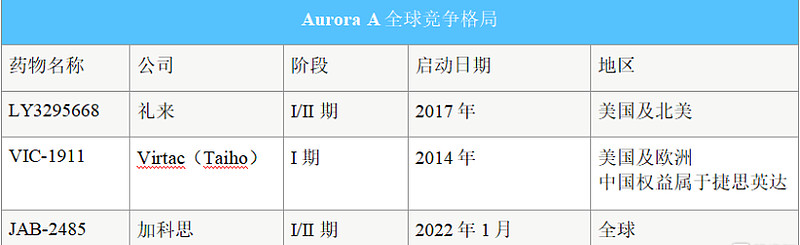
加科思的Aurora A抑制剂JAB-2485目前正在美国进行I/IIa期临床研究,是第三家在美国进行临床试验的Aurora A抑制剂。JAB-2485是一款高选择性的Aurora A抑制剂,能避免此前很多公司研发的Pan Aurora抑制剂既能作用于Aurora A又能作用于Aurora B造成骨髓毒性强的问题。
05 KRASmulti抑制剂:PD-1后的下一个广谱抗癌药
加科思的KRASmulti抑制剂JAB-23E73是一个超广谱靶向药,大约23%的癌症患者带有KRASmulti相关突变,目前全球仅一个泛RAS项目处于临床阶段。全球每年新增270万带有KRAS相关突变的患者,中国每年新增近60万患者带有KRASmulti可覆盖的突变类型(G12D、G12V、G12R、G12S、G12A、G13D以及G61H等),市场潜力是KRAS G12C的8-10倍。加科思以全球前三的进度进入临床,临床前数据显示该分子活性同类最强,预计于今年中提交IND。
06 iADC:有望成为PD-1无效患者的新选择
在靶向药以外,加科思也在研究下一代肿瘤免疫疗法——iADC,用免疫刺激剂STING替代毒素载荷,通过“免疫激活剂+化疗”,解决PD-1无效的问题,打开肿瘤治疗的新时代。目前全球仅Mersana公司的HER2-STING ADC XMT-2056进入临床阶段,该产品曾以14.6亿美元的总价授权给GSK。根据公开数据显示,加科思的HER2-STING iADC JAB-BX400在临床前展现出良好的血浆稳定性及强劲的抗肿瘤效果,安全性显著优于XMT-2056,预计今年确定临床候选分子,2025年申报IND。
(via 加科思)