整理|medium
编辑|于靖
1月23日,和黄医药宣布其子公司和记黄埔医药与武田制药子公司达成独家许可协议——将在除中国内地、香港和澳门以外的全球范围内进一步推进呋喹替尼的开发、商业化和生产。
根据协议,和黄医药将可收取首付款4亿美元,以及可高达7.3亿美元的潜在未来里程碑付款,总额可高达11.3亿美元,并外加基于净销售额的特许权使用费。和黄医药计划将于2023年完成在美国、欧洲和日本的呋喹替尼上市许可申请提交。

呋喹替尼是一种高选择性、强效的血管内皮生长因子受体 (VEGFR) 1/2/3抑制剂。该药物可通过口服给药,并有潜力用于转移性结直肠癌的各种亚型中且不受生物标志物状态影响。
作为始于结肠或直肠的癌症,结直肠癌亟需更有效的疗法。根据国际癌症研究机构 (IARC) 的数据,结直肠癌是全球第三大常见癌症,在2020年估计造成超过93.5万人死亡。尽管早期结直肠癌能够通过手术切除,但转移性结直肠癌目前治疗结果不佳且治疗方案有限,仍然存在大量未被满足的医疗需求。
VEGFR抑制剂在抑制肿瘤的血管生成中起到至关重要的作用。呋喹替尼的独特设计使其激酶选择性更高,尽可能地降低脱靶毒性、改善耐受性并对靶点提供更稳定的覆盖。
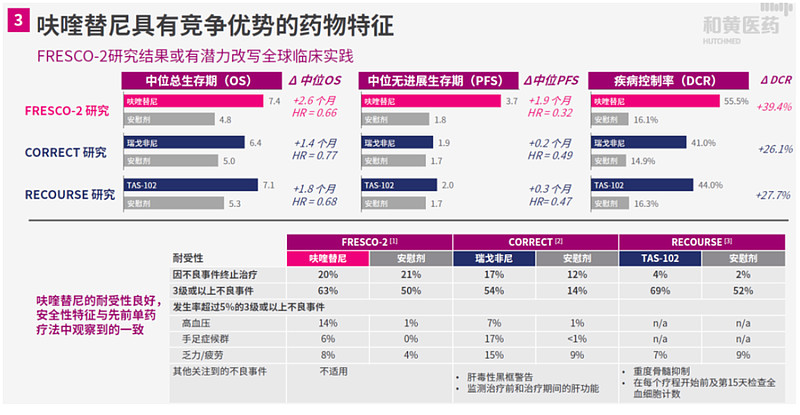
其中,呋喹替尼用于治疗难治性转移性结直肠癌患者的FRESCO-2国际多中心III期临床试验已取得积极结果,并于2022年9月举行的欧洲肿瘤内科学会 (ESMO)年会上公布。在该试验中,呋喹替尼在转移性结直肠癌患者中达到了改善总生存期 (OS)的主要研究终点,且一般耐受性良好。
2018年9月,呋喹替尼获NMPA批准在中国销售,并于同年11月以商品名“爱优特”上市。2020年1月起,该药被纳入中国国家医保药品目录,用于既往接受过氟嘧啶、奥沙利铂和伊立替康治疗的转移性结直肠癌患者,包括既往接受过抗VEGF治疗和/或抗EGFR治疗 (RAS野生型) 的患者。
在2022年12月,和黄医药宣布开始向美国FDA递交呋喹替尼用于治疗难治性结直肠癌的滚动上市申请。如其早前所公布,美国、欧洲和日本的上市许可申请提交计划于2023年完成,其中向FDA的滚动提交计划于2023年上半年完成。
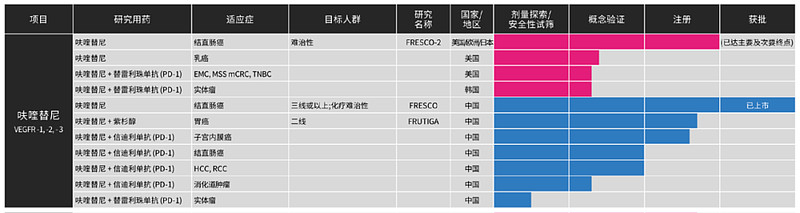
和黄医药在2000年成立,但直到2018年,才推出首款抗癌药物呋喹替尼,2021年,索凡替尼、赛沃替尼先后上市。
此后,三款创新药撑起了和黄医药的肿瘤免疫业务。数据显示,呋喹替尼2022年上半年的市场销售额为5040万美元,增速26%;索凡替尼2022年上半年的市场销售额为1360万美元,其于2022年1月起首次获纳入国家医保药品目录;赛沃替尼2022年上半年的市场销售额为2330万美元。
受这三款自主研发肿瘤创新药的商业化稳定推动,和黄医药肿瘤及免疫业务2022年上半年综合收入增长113%至9110万美元。
其中,核心产品索凡替尼的出海之路却并不顺利。在2022年5月,和黄医药披露了FDA关于旗下产品在美上市的回复函。在回复函中,FDA以美国患者数据不够多,数据不足以支持获批为由,驳回了索凡替尼的申请,要求和黄补做国际多中心临床试验。
同年11月,和黄医药宣布进行战略转变,专注于内部开发管线中最前沿、最有可能推动近期价值的药物。
根据公告,其战略调整主要包括:优先考虑其后期注册研究及通过监管机构的批准这些药物上市,特别是呋喹替尼的全球注册;某些早期研究不会再被优先考虑用于内部开发,而某些其他项目会考虑外部商业机会;寻求潜在的合作伙伴,将其药物在中国境外商业化;简化组织、重新部署关键人才以支持注册研究和监管申请等。
此次与武田制药的合作,将带给和黄医药丰厚的现金流,推动更多在研管线的进展。在春节期间,可谓是2023年国内药企出海的好兆头。
参考资料:
1.和黄医药官网
2.李嘉诚旗下公司也没钱了!和黄医药连续三年亏损上亿美元;华夏时报