
撰文丨不器
编辑丨于靖
能否将中国开发的PD-1推向美国市场?今年以来,已经有数家公司在这一问题上受挫。最近的一次尝试结果,来自诺华和百济神州。
7月12日,原本是替雷利珠单抗(tislelizumab)二线治疗食管癌(ESCC)上市申请的审批节点,却迟迟未传出FDA是否批准的消息。两天后,百济神州发布公告称,该BLA因为COVID-19疫情无法完成现场核查工作,因此FDA将延长审评时间,直至现场核查完成。
但FDA尚未提供更新的PDUFA日期。如果这是诺华和百济神州在PD-1合作上的首次重大失利,那么7月19日,替雷利珠单抗迎来了又一轮挑战。
01 放弃PD-1单药治疗NSCLC
在诺华的第二季度电话会上,诺华首席执行官Vas Narasimhan透露,诺华和百济神州目前暂无计划在收到“FDA反馈”后申请替雷利珠单抗单一疗法适应症。Vas Narasimhan指的是替雷利珠单抗单药用于非小细胞肺癌(NSCLC)的相关申请。换言之,诺华放弃在美国递交替雷利珠单抗作为NSCLC单药疗法的BLA希望。
根据Endpoints的报道,“FDA反馈”的结论是,由百济神州推动的研究“并没有充分反映美国的患者数量和所使用的护理标准”。
替雷利珠单抗治疗NSCLC的海外申报,基于RATIONALE-303、RATIONALE-304和RATIONALE-307三项临床试验结果,共纳入了1499例患者。
2021年1月,替雷利珠单抗在中国获批首项肺癌适应症,即联合两项化疗用于治疗一线晚期NSCLC患者,所依赖的数据来自在中国大陆地区开展的RATIONALE-307。同年6月,替雷利珠单抗获批联合化疗用于治疗一线晚期非鳞状NSCLC患者,同样基于中国开展的RATIONALE-304。
与前述两项研究范围不同,RATIONALE-303共在美洲、欧洲、亚洲和大洋洲的10个国家入组805例患者,以2:1的比例随机至替雷利珠单抗试验组或多西他赛对照组。
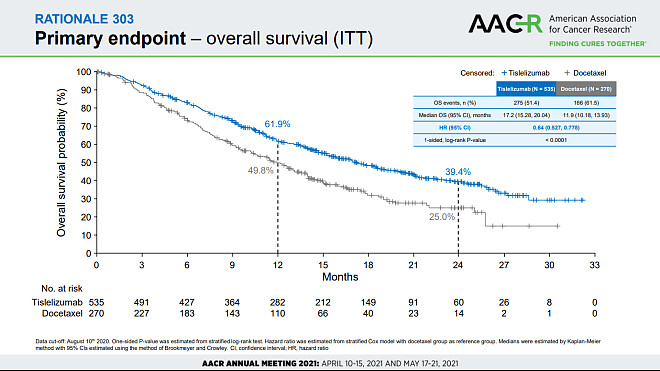
RATIONALE-303临床数据(图源:诺华)
RATIONALE-303旨在评估雷利珠单抗治疗接受铂类化疗后出现疾病进展的二线或三线局部晚期或转移性NSCLC患者有效性和安全性,试验主要终点是意向治疗(ITT)人群和确定具有高PD-L1表达的患者子集的总生存期(OS)。在ITT人群中,中期分析数据显示,实验组和对照组的中位总生存期(mOS)分别为17.2个月、11.9个月。在高PD-L1表达的患者子集中,实验组和对照组的mOS分别为19.1个月、11.9个月。
如果说,两个月前Coherus和君实生物在PD-1闯关FDA上的被拒来自较易更改的质控流程——事实上,本月初君实生物已重新递交相关BLA,PDUFA日期为12月23日——那么,诺华和百济神州在NSCLC适应症申报方面的问题,恐怕像更早前礼来和信达生物遭遇的境况。
彼时,FDA聚焦的核心问题之一,便是单国临床研究数据是否适用于美国患者。FDA专家委员会以14:1的投票结果,认为信迪利单抗应该补充临床试验才能获得批准。最终,FDA参照这一意见给礼来和信达生物发出CRL。
诺华的担忧部分在此。Vas Narasimhan在电话会上强调:“我确实认为FDA现在已经明确表示,他们希望提交的任何研究都是全球性的,后者有适当数量的美国患者,并且使用的护理标准也能反映美国的相关要求。”
5月20日,美国E&C Republicans网站公布一则新闻,三位共和党人Cathy McMorris Rodgers 、Brett Guthrie和Morgan Griffith联名向FDA局长Robert Califf发送了一封关于中国临床试验的信函。信中称,仅依赖于单一国家患者入组的临床试验可能无法代表美国患者群体。
“因为来自单一外国的试验通常在种族和人群种族代表性上与美国不同,需要提供额外的数据,以确保产品结果对美国人群的适用性。”上述信函引用了FDA官员Harpreet Singh和Richard Pazdur此前的评论说道。
因此,Vas Narasimhan表示,他现在的关注重点将是优先完成最有可能成功的替雷利珠单抗二线治疗ESCC的BLA,而非考虑挤满PD-(L)1的美国NSCLC市场。
02 并购背后的机会有待验证
排除COVID-19带来的不可抗力因素,二线治疗ESCC确实是诺华在美国推动替雷利珠单抗最接近成功的适应症。6月30日,诺华和百济神州宣布,替雷利珠单抗联合化疗一线治疗食管癌(ESCC)的全球III期临床RATIONALE-306获得成功,相对化疗显著改善生存数据。
具体来看,联合治疗组将mOS从对照组的10.6个月延长6.6个月,至17.2个月,这也是PD-1一线治疗ESCC的最佳数据——从延长的数据对比,默沙东的Keytruda是2.6个月,BMS的Opdivo是2.5个月,恒瑞医药的卡瑞利珠是3.3个月、信达生物的信迪利单抗是4.2个月、君实生物的特瑞普利单抗是6.0个月。
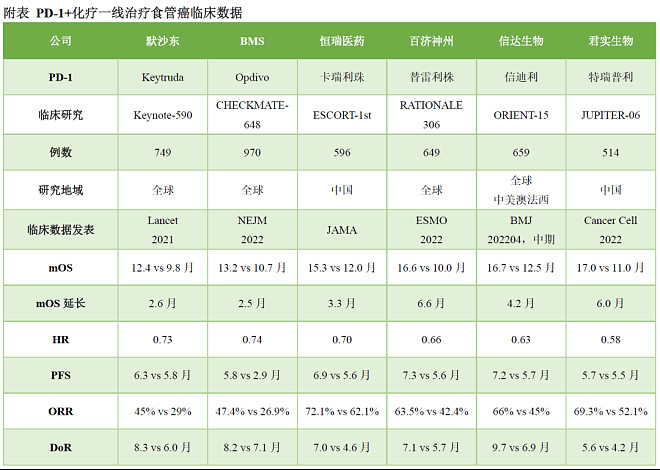
PD-1联合化疗一线治疗食管癌临床数据对比(图源:医药笔记)
自诺华2021年1月引进替雷利珠单抗以来,后者已在中国获批多项适应症,不过鉴于美国市场的变化和COVID-19造成的影响,替雷利珠单抗何时进入美国市场尚未可知。
虽然此次电话会上释放出抛弃替雷利珠单抗NSCLC适应症的消息,诺华似乎也不打算完全“割席”。根据第二季度财报,诺华计划今年向FDA提交替雷利珠单抗用于一线鼻咽癌治疗的BLA。
此外,诺华也在寻找新的并购机会,以满足公司业绩增长的需要。诺华首席财务官Harry Kirsch暗示,行业很快就会在这方面看到诺华的动作,因为其拥有相当强大的并购资本。
4月初,诺华起草了将制药和肿瘤业务结合的计划。作为重组计划的一部分,诺华专门设立设立首席战略和增长官,一个负责公司战略、研发组合战略和业务发展的新职位。这是针对Vas Narasimhan的既定目标,即改善诺华在美国市场的弱势地位,并计划进入重要细分市场的前5名。随后,诺华聘请华尔街资深分析师Ronny Gal牵头并购活动。
Vas Narasimhan曾表露,今年下半年诺华可能会有更多的并购活动,前提是筛查出具有吸引力的公司。据估计,到2024年,诺华的重组每年至少节省10亿美元。
问题在于,美国联邦贸易委员会(FTC)已经对生物制药行业的整合,以及现有龙头企业通过并购扩大的市场力量有所担忧。2021年3月起,FTC一直在与国际同行合作,修订制药公司的反垄断审查。
FTC的专家们认为,规模扩张并不能推动生物制药领域的创新。宾夕法尼亚大学医疗保健经济学专家Patricia Danzon表示,过去几年中,大型制药公司的新药份额逐渐下降,反倒是小公司贡献了大约70%的新药实体。
研究发现,合并后的药企研发产出下降,人们担心买家会通过收购竞争者阻碍创新。
专家们还担心,大药企在药品定价谈判中议价能力的增强会扰乱市场秩序。如果合并后的生物制药公司拥有一种“必需”或重磅产品,那么这家公司可以将明星药品与收购获得的新产品捆绑,从而推高价格。许多数据表明,市场高度集中与药品价格上涨之间有很大的关系。
等待诺华的,还有一堆不甚简单的事务要处理。例如,怎样为CPK850(治疗色素性视网膜炎)、CSJ117(治疗哮喘)、LJN452(tropifexor,治疗NASH)这3个处在II期临床的创新药物找到合作伙伴?
在过去的几年中,诺华尝试将LJN452与辉瑞和Allergan的药物联用,但clinicaltrials.gov收录的资料显示,这两项关于NASH的研究已被叫停。
另外,诺华仿制药部门Sandoz的去留也影响着公司整体的走向。至少自2019年以来,关于分拆的传闻一直不断。今年第二季度,Sandoz的业绩稳健,诺华由此预计今年Sandoz将有较低的个位数增长。Vas Narasimhan表示,他将在今年底前决定,是否剥离这一仿制药和生物类似药部门。
参考资料:
1.Novartis scraps key PD-1 submission, while touting 'significant bolt-on M&A firepower';Endpoints
2.百济神州大涨16%:PD-1一线食管癌全球三期临床获最佳生存数据;医药笔记
3.诺华重组进行时:将有数千人被裁,仿制药部门去留未定;同写意
4.FTC打击药企并购,大型交易或将面临“寒蝉”效应;同写意