
撰文丨不器
编辑丨于靖
随着JAK抑制剂Oluminant(baricitinib,巴瑞替尼)的又一次获批,美国市场迎来首款斑秃(AA)疗法。按照美国皮肤病学会(AAD)的数据,上千万的患者有望获得重生头发的转机。
不只是美国,斑秃在全球范围来说都属于一种发病率较高的脱发症状,超过1亿人深受其扰,不论年龄、性别和种族。顾名思义,这种疾病的临床表现,是突然的、不明原因的局部性或者全部性脱发,并形成显著斑块状脱发。
既往研究表明,斑秃由免疫介导的过程引起,这一过程牵涉依赖JAK-STAT通路激活和增殖自身反应性T细胞的细胞因子。简单理解,免疫系统对毛囊上皮细胞的攻击导致脱发,阻断上述环节的JAK抑制,于是被科学家所关注。
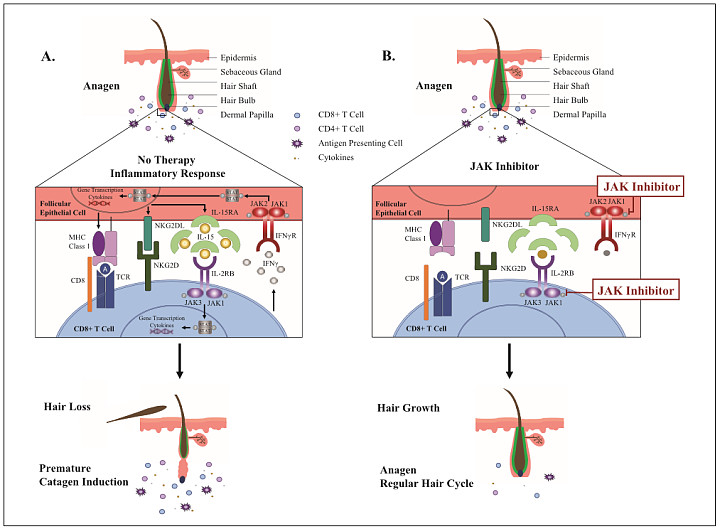
斑秃发生机制与JAK抑制阻断免疫级联反应过程
长期以来,斑秃治疗手段十分有限,未尝没有药企入局尝试。但在2019年,Aclaris开发的JAK抑制剂遭遇治疗斑秃II期临床的失败。直到6月14日,获得FDA批准的Oluminant,才打破了这一领域特效药的空白。
Oluminant进军斑秃治疗收获一路关注。2020年3月,得益于一项II/III期临床(BRAVE-AA1)的积极数据,Oluminant被FDA授予治疗斑秃患者的突破性疗法认定。
随后,礼来宣布,Oluminant在两项共入组1200例重度斑秃患者的III期临床达到主要终点——第36周的SALT(脱发严重程度工具)评分为20或更低。
根据标准,重度斑秃被定义为头发缺失面积超过50%(SALT≥50%),基线平均SALT为85.5,即平均缺失面积为85.5%,头发覆盖面积仅14.5%。同时,69.4%的患者有显著的眉毛缺失、57.9%的患者有显著的睫毛缺失。
BRAVE-AA1研究显示,接受剂量为4mg Oluminant治疗的患者,在第16周时,18.5%达到头皮毛发覆盖面积80%以上的标准,对照组的数字仅4.2%(p<0.001)。
另一项BRAVE-AA2研究也证实,接受剂量为4mg Oluminant治疗的患者,最早在24周时头皮毛发再生获得统计显著改善。28.2%患者头皮毛发覆盖率超过80%,达到同样标准的对照组人数占比为1.3%(p<0.001)。

BRAVE-AA1与BRAVE-AA2研究疗效数据
今年3月,Oluminant上述结果在《新英格兰医学》(NEJM)上发表。这一重磅消息经由2022年AAD年会,引起业界的极大兴趣。
而会上,礼来公布的52周治疗数据,更是为其巩固业内公认的“首款斑秃治疗药物”地位再添一锤。后者表明,对4mg剂量Olumiant治疗有反应的重度斑秃成年患者中,近75%在52周时头皮的头发覆盖率达到九成。
但在获批新适应症前,也有声音担心,作为JAK抑制剂的Olumiant,是否存在安全性问题。
2020年,一个独立监测委员会发现,在与肿瘤坏死因子(TNF)消炎药进行上市后比较研究时,辉瑞的JAK抑制剂Xeljanz高剂量组患者死亡人数比低剂量组,或接受两种TNF抑制剂之一(Enbrel或Humira)患者死亡人数更多。辉瑞就此暂停整个高剂量组试验。
FDA警告称,低剂量的Xeljanz“出现严重心脏相关问题和癌症的风险增加”。2021年9月,FDA给所有JAK关节炎药物作出严重的黑框警告,此举也波及礼来的Olumiant,因为它与Xeljanz具有相同的作用机制,这足以引起FDA的担忧。
不过,至少在Olumiant治疗斑秃的两项III期临床中,并未观察到足以“宣判死刑”的风险。
研究显示,Olumiant的安全性特征与此前发表的安全性数据一致,小于2.6%的患者因为不良事件停止接受治疗。大多数治疗相关不良事件为轻度或重度,最常见的不良事件为上呼吸道感染、头痛、粉刺、尿道感染和与肌肉相关的血液标志物升高。
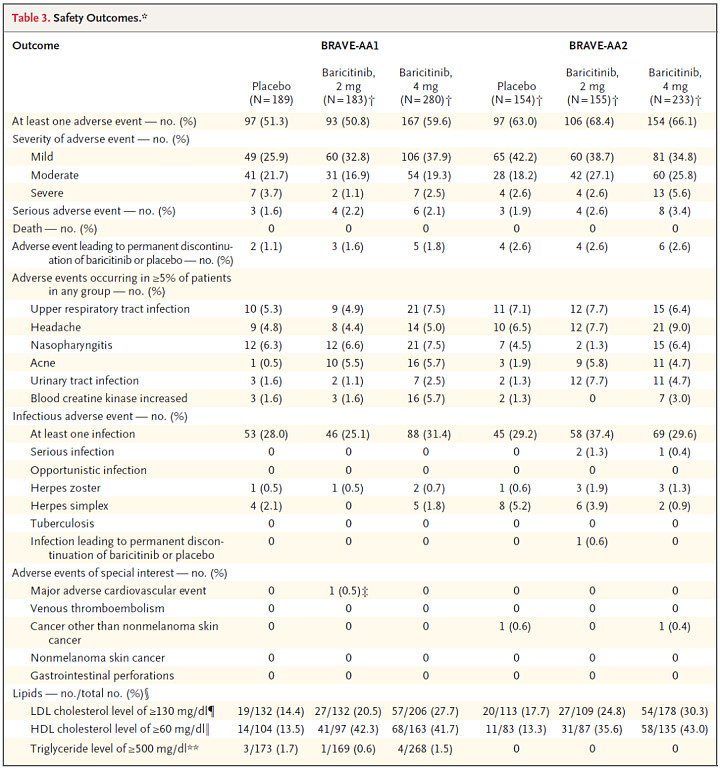
BRAVE-AA1与BRAVE-AA2研究安全性数据
作为FDA批准的首款斑秃领域系统性疗法,Olumiant至少能领先一众同行半个身位。
目前,辉瑞的JAK3/TEC抑制剂ritlecitinib、Concert Pharmaceuticals的JAK1/2抑制剂CTP-543均在治疗斑秃的的III期临床中取得积极顶线结果。国内方面,泽璟制药的JAK抑制剂杰克替尼已经启动III期临床,和瑞石生物的JAK1抑制剂SHR0302也顺利完成II期临床。
上述竞品都处在后期开发阶段,但礼来也没有打算就此停下步伐。礼来全球免疫学开发和医学事务副总裁Lotus Mallbris此前透露,礼来预计2022年结束前,Olumiant将在美国、欧洲和日本获得治疗斑秃的注册批准。
FDA批准之前,5月,EMA人用医药产品委员会(CHMP)已发布一份积极审查意见,推荐批准Olumiant用于治疗成人重度斑秃。CHMP的意见将递交至欧盟委员会(EC)审查,后者预计在未来2个月内做出最终审查决定。
随着Olumiant在斑秃领域的“开疆拓土”,礼来的自身免疫业务板块正快速成长——尽管它可能还非常年轻。
2021年,礼来营收283.18亿美元,同比增长15%。而具体到不同疾病,糖尿病领域仍是礼来的创收支柱,包括Trulicity(度拉糖肽)、Humulin(重组人胰岛素)、Humalog(赖脯胰岛素)、Jardiance(恩格列净)在内的等8款产品组合,合计贡献131.88亿美元营收,在同期总收入的占比高达46.6%。
与之对比,礼来能拿得出手的自身免疫产品,除了Olumiant,便是Taltz(ixekizumab)。
上一年度财报显示,已在斑块型银屑病(PsO)、银屑病关节炎(PSA)和强直性脊柱炎(AS)方面获得批准的Taltz,全球范围内为礼来创造22.13亿美元的收入,同比增长24%。
Olumiant算是礼来手中直追Taltz另一款自身免疫产品,该药在2021年全年的销售额虽仅有11.15亿美元,却相较去年增长了75%。值得注意的是,礼来在年报中指出,Olumiant全球使用量的增加,部分原因在于Olumiant获批用于新冠肺炎住院患者。
加上斑秃的适应症,Olumiant已经拿到三个领域的使用许可。2018年,Olumiant最先获得治疗类风湿关节炎(RA)的批准。2020年,Olumiant被允许和吉利德的Veklury(瑞德西韦)联合用于新冠肺炎(COVID-19)患者的住院治疗。18个月后,FDA批准Olumiant成为治疗新冠肺炎的唯一一款免疫系统调节剂和JAK抑制剂。
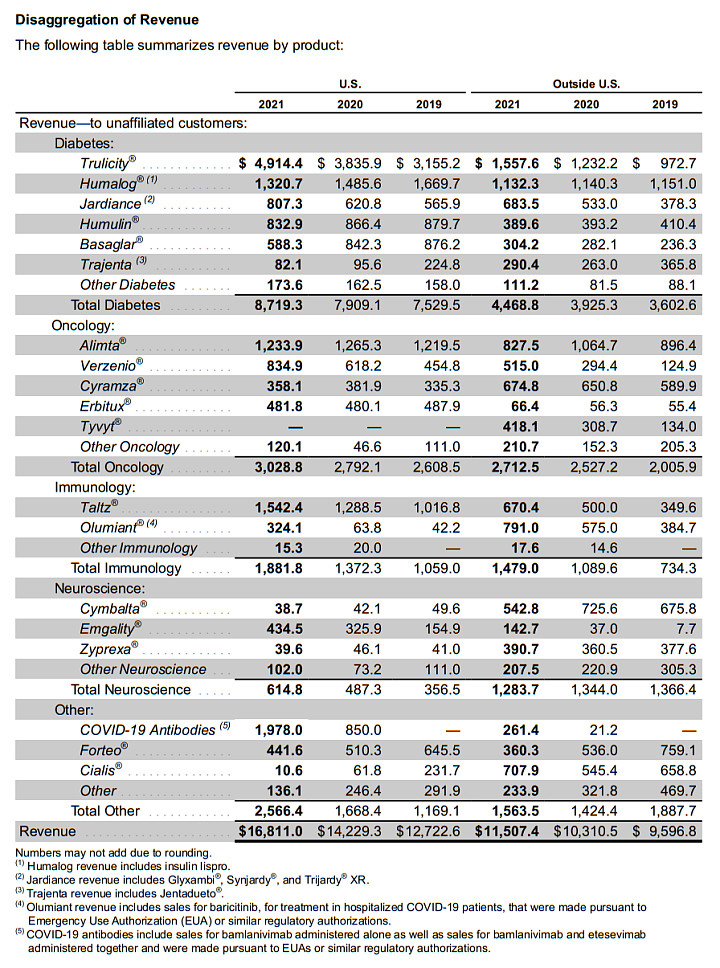
礼来2021年财报业绩(按产品计)
另一厢,我们也应该看到礼来在自身免疫方面的绝对差距。
2021年,Olumiant、Taltz加上其他“未成气候”的产品,礼来的自身免疫板块总收入为33.61亿美元,排在糖尿病板块(131.88亿美元)、肿瘤板块(57.41亿美元)之后,仅超过神经系统板块(18.99亿美元)。
礼来似乎已经注意到这些不足。2020年,礼来以约11亿美元对价,收购致力于开发慢性皮肤病疗法的Dermira,获得后者在研的中重度特应性皮炎(AD)药物IL-13单抗lebrikizumab,以及一款已被FDA批准治疗原发性腋窝多汗症(primary axillary hyperhidrosis)的Qbrexza(glycopyrronium)。
可惜的是,这次牵手并未能像在Olumiant项目上那么长久——2009年12月,礼来与Incyte达成7.55亿美元合作,从Incyte引进开发和商业化Olumiant。2021年4月,礼来宣布关闭Dermira工厂,裁员163人,将Qbrexza出售给Journey Medical,只保留下lebrikizumab的权益。
艰难之处还体现在Olumiant其他适应症的开发上。今年2月,根据来自两项关键III期临床(SLE-BRAVE-I和SLE-BRAVE-II)的顶线疗效结果,礼来决定终止Olumiant治疗活动性系统性红斑狼疮(SLE)的III期开发项目。
其中,SLE-BRAVE-I研究达到主要终点,SLE-BRAVE-II研究未达到主要终点。此外,这两项研究均未达到关键次要终点。
纵使如此,礼来仍对其在自身免疫领域有所作为抱以期待。礼来的免疫学总裁Patrik Jonsson接受采访时说,斑秃非常适合礼来目前的“基础建设”,因为其拥有专业的皮肤病学积累,“无论从开发方面,还是从患者角度”。
现阶段,礼来的免疫学研究主要围绕三个方面展开:Olumiant已先后在类风湿关节炎、新冠肺炎和斑秃取得成功;mirikizumab正在溃疡性结肠炎(UC)领域尝试突破,致力于成为首个获批的IL-23抑制剂;lebrikizumab则在调整其在特应性皮炎方面的策略。
后二者的获批时间表尚未可知。但在4月,礼来透露,已向FDA提交mirikizumab的上市申请,并计划在2022年底前完成lebrikizumab相关申请的提交。根据一项为期12个月的评估,如果一切顺利,这些项目可能会在2023年获得批准。
主要参考资料:
1.头皮覆盖率达到90%!礼来JAK 抑制剂Olumiant有望成为第一个斑秃适应症标签药物;同写意
2.可恢复80%头发生长,FDA批准首款口服斑秃疗法;药明康德
3.Two Phase 3 Trials of Baricitinib for Alopecia Areata;NEJM
4.The Use of Janus Kinase Inhibitors in Alopecia Areata: A Review of the Literature;JCMS
5.Eli Lilly revs up immunology engine as Olumiant cruises toward coveted alopecia green light;Fierce Pharma
6.CHMP Recommends Approval of Lilly and Incyte's OLUMIANT® (baricitinib) as the First and Only Centrally-Authorized Treatment for Adults with Severe Alopecia Areata (AA);Lilly
7.Updates on OLUMIANT® (baricitinib) Phase 3 lupus program and FDA review for atopic dermatitis;Lilly
8.Lilly Reports Solid Fourth-Quarter and Full-Year 2021 Financial Results, Recent Late-Stage Pipeline Successes Set Up Next Wave of Innovative Medicines for Patients;Lilly