
撰文丨不器
编辑丨于靖
在Bluebird bio决定撤出欧洲市场的近半年后,另一家基因疗法开发公司PTC Therapeutics正跃跃欲试,推动其创新产品的商业化落地。
5月20日,PTC获悉,欧洲药品管理局(EMA)人用药品委员会(CHMP)支持其在研基因疗法Upstaza的上市,用于治疗芳香族L-氨基酸脱羧酶缺乏症(AADCD)。这意味着,PTC距离登陆欧洲市场只差临门一脚。
Upstaza之所以引人关注,一方面在于其所针对的适应症。
全球已知的罕见病超过7000种,约占人类疾病的10%。按照WHO的定义,罕见病是指患病人数占总人口数0.65‰-1‰的疾病。而AADCD的情况更加罕见,现阶段只在数百名患者身上发现。并且,同大多数罕见病的命运一样,市场上至今没有改变AADCD疾病进程的疗法。
AADCD是由多巴胺(dopamine)缺乏引起的衰弱造成运动和非运动功能障碍。从机制上说,编码AADC酶的DDC基因变异,导致AADC酶功能缺失,使得AADCD患者通常出生几个月内就会发生严重残疾和伤害。
为此,PTC开发了一款利用腺相关病毒2(AAV2)载体的基因疗法。Upstaza旨在通过一次性治疗,将功能正常的DDC基因直接输注到大脑的壳核中,提高AADC酶的水平并恢复dopamine的生产。
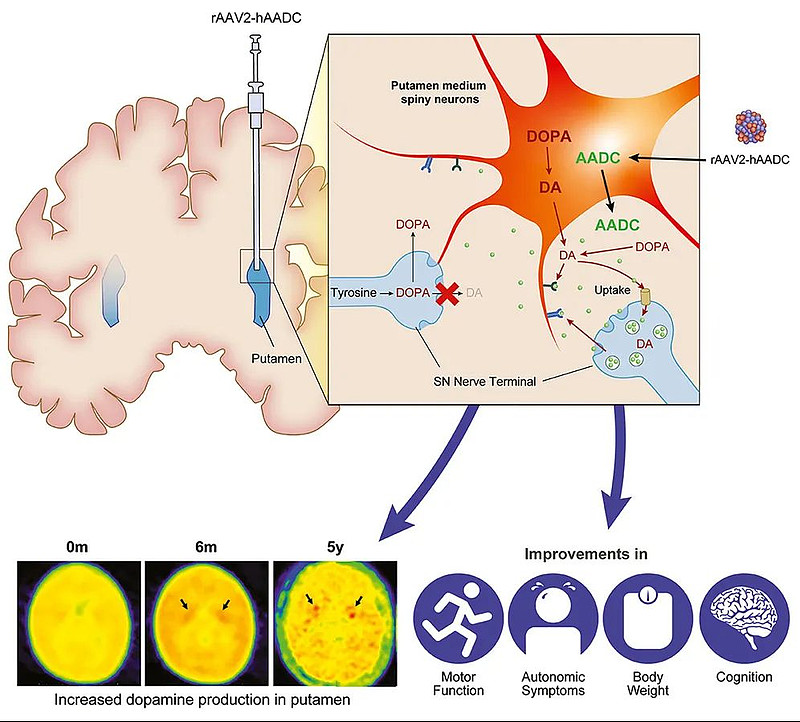
PTC在2021年9月的第50届儿童神经学会年会会议上,公布了Upstaza的五年分析结果。数据指示,患者的运动功能改善得以持续,证明单次给药的可行性。在三项临床试验中,所有儿童从治疗后第3个月开始,就记录到运动发育的改善。根据Bayley-III分数评估,认知和语言技能也比基线显著提高,儿童能够理解他们的照顾者并表达自己。
此外,呼吸道感染率从12个月时的平均2.4次/年,下降到2年时的0.6次/年、5年时的0.3次/年。几乎所有接受治疗的儿童在使用后Upstaza的12个月内,体重从低于第三个百分位数的基线增加到适合其年龄的水准。
基于在28名年龄在18个月至8岁6个月的儿童中验证的数据,PTC向EMA递交了相关上市申请。PTC预计,获得CHMP支持后,EMA将在两个月内做出最终决定。如果获得批准,Upstaza将是治疗18个月以上AADCD患者的首个改变疾病进程的疗法,也成为首个直接输注到大脑的基因疗法。
PTC的合作伙伴ClearPoint Neuro总裁兼首席执行官Joe Burnett认为,CHMP的支持态度给其他疗法提供了一条潜在的路径,并为监管部门批准直接输注大脑的基因疗法开创重要的先例。
不过,相较等待破纪录的两个月,PTC和Upstaza还有更长的周期要面对。从这一点上,结束欧洲业务的Bluebird提供了现实的问题——商业化。
2019年5月,Bluebird在欧洲推出Zynteglo,后者顶着“全球首个治疗β-地中海贫血的基因疗法”,但直到2021年2月,第一位患者才在临床试验之外接受治疗,此后Bluebird并没有从销售中获得任何实质性收入。
部分原因在于,Bluebird和支付方无法就Zynteglo高达180万美元的价格达成一致。而随着现金储备迅速减少,今年3月Bluebird自称对其未来一年保持偿付的能力“严重怀疑”。
在同写意近期举办的一次直播讨论中,业内人士指出,罕见病是进入基因治疗的一个收益与风险平衡的切入口,但这只是一个起点。科学家、公司产品开发者和监管部门,都是基于产品在临床推动中所积累的各项数据,共同学习和推进了解它的药效、安全性,以此进入到下一个循环,进入到更广阔的市场。这中间有一个非常大的时间成本。
尽管PTC可能会给近期屡屡受挫的基因疗法带来希望,欧洲市场却并非Upstaza的终点。2021年,PTC从销售、合作和特许权使用费中获得了5.39亿美元的收入。然而,由于高额的研发等开支,PTC同期亏损5.24亿美元。
Upstaza能否进入下一个循环,关键在于会不会被更多的监管机构批准,尤其是FDA。PTC透露,Upstaza预计也会在今年接受FDA的审查。
加拿大皇家银行(RBC)分析师布Brian Abrahams表示,PTC已经确认了300名AADCD患者,Upstaza上市后,预计PTC在欧洲的年收入将达到6000万美元。并且,Abrahams推测,Upstaza获得包括EMA、FDA和其他监管机构的批准,可能会为PTC带来额外的2亿美元年收入。
主要参考资料:
1. PTC's first gene therapy gains European regulator's backing;BioPharma Dive
2. Results Show Long-Lasting and Holistic Improvements in Children with AADC Deficiency Treated with PTC-AADC Gene Therapy;PTC Therapeutics
3. Long-term efficacy and safety of eladocagene exuparvovec in patients with AADC deficiency. Molecular Therapy;Molecular Therapy
$Ptc Therapeutics(PTCT)$ $bluebird bio(BLUE)$ $和元生物(SH688238)$