撰文丨medium
编辑丨于靖
新药研发颇具风险。是及时止损,还是让子弹飞一会儿,或许只有等到最后一刻才知自己决策是否正确。
4月13日,GSK对外发布公告称,将以19亿美元收购一家专注于罕见癌症治疗的生物制药公司Sierra Oncology。这可以称得上是今年生物科技领域最大的收购之一,预期在今年的第三季度完成。

业界对此次合作的关注核心,是一款近乎获批的抗癌药物momelotinib。今年1月份,Sierra披露momelotinib III期临床试验结果,该药物达到了所有主要和关键次要终点。GSK意在补充其血液学管线,期待momelotinib可在2023年为其带来积极收入。
III期成功的背后,是momelotinib鲜为人知的坎坷经历。巨头乘兴而来,败兴而归。Sierra如何从吉利德手里捡漏?又是如何变废为宝?背后的博弈故事值得探究。
01 屡遭易手,低价抛售
momelotinib是一种选择性口服JAK1、JAK2和ACVR1抑制剂,起初是由一家名为Cytopia的澳大利亚公司开发。
有意思的地方在于,作为momelotinib的主要贡献者、Cytopia的拥有者,Andrew Wilks最初发现了JAK。在1989年和1991年间,Andrew Wilks等人相继发现两个TYK(酪氨酸激酶),这些蛋白质有两个奇怪的结构域——一个正常的激活结构域,另外一个与其高度相似。Andrew Wilks将这两个TYK起名为“Janus Kinase 1和2”(Janus是罗马神话中头长两幅面孔的门神),也有JAK是“Just Another Kinase”的说法。
可以说,momelotinib“师出名门”。2009年,加拿大生物制药公司YM Biosciences以1400万美元收购了Cytopia。
在2012年吉利德接手momelotinib前,YM Biosciences已经完成了II期试验。momelotinib在该II期试验中表现出良好的疗效——脾体积降低,几乎没有血小板减少的贫血益处。但那时,YM Biosciences已无资源开展III期临床,于是吉利德以5.1亿美元收购了该公司。
不过,摆在吉利德面前的,首先是Incyte/诺华开发的Jakafi于2011年获得FDA批准。为了赶超Jakafi在骨髓纤维化(MF)领域先发之势,吉利德迅速启动与Jakafi头对头的III期临床试验(SIMPLIFY-1)。
紧接着,吉利德遭遇另外的严峻挑战——招募不到新的MF患者参与其III期临床试验,因为既往已经接受过JAK抑制剂的患者被禁止参与试验(Jakafi的获批造成了其招募困难)。而试验期间,Jakafi的发货延迟造成的药物短缺也迫使吉利德延后患者招募。
2016年底,吉利德公布momelotinib的III期临床试验结果。结果不尽人意,SIMPLIFY-1达到了主要终点,证明其脾脏反应率不劣于Jakafi,但总症状评分(TSS)中的反应率未达到关键次要终点。同时,SIMPLIFY-2(患者先前接受过Jakafi治疗)未达到momelotinib优于最佳替代疗法组的主要终点。
对吉利德来说,2016年注定是艰难的一年:多个开发管线接连受到挫折而叫停,momelotinib给予其最后一击,似乎该药物只能被定位为me-too,还谈不上是Jakafi强有力的竞争对手,尤其是在Jakafi一年的销售额已达到10亿美元的情况下。
2018年,心灰意冷的吉利德做出了放弃momelotinib的决定,将其权利转让给Sierra,包括300万美元的首付款在内,对价总计1.98亿美元。
02 苦尽甘来,起飞预备
1.98亿美元对Sierra来讲,并不是一个小数字。那时Sierra整个公司的市值才仅1.35亿美元,不得不向银行贷款1500万美元来缓和现金流。
Sierra审查了之前的试验数据。与吉利德悲观的看法不同,Sierra认为momelotinib既往的数据表现出对MF治疗的积极信号,即对MF患者的三项关键指标:贫血、全身症状和脾脏大小,均有积极影响。2019年这一年,Sierra全身心投入momelotinib开发计划中。
一路走来,Sierra的股价一度跌破10美元(被GSK收购时股价为55美元)。而事实证明,Sierra赌赢了。
研究人员将195名曾接受过JAK抑制剂治疗的MF患者随机分配,接受momelotinib或者类固醇达那唑口服24周,达那唑是治疗MF患者贫血的推荐药物之一。今年1月末,Sierra公布了III期数据。
在用于评估MF症状严重程度的记分卡上,25%接受momelotinib治疗的患者,9%对照组患者报告了记分50%的降幅。此外,momelotinib治疗组中31%的患者在第24周时不依赖输血,相比之下,对照组仅为20%,同时momelotinib可缩小脾脏大小35%以上,不良反应率也低于对照组。
值得一提,momelotinib是首个也是唯一一个在疾病症状、脾脏反应、贫血的所有关键标志物方面均显示阳性数据的JAK抑制剂。
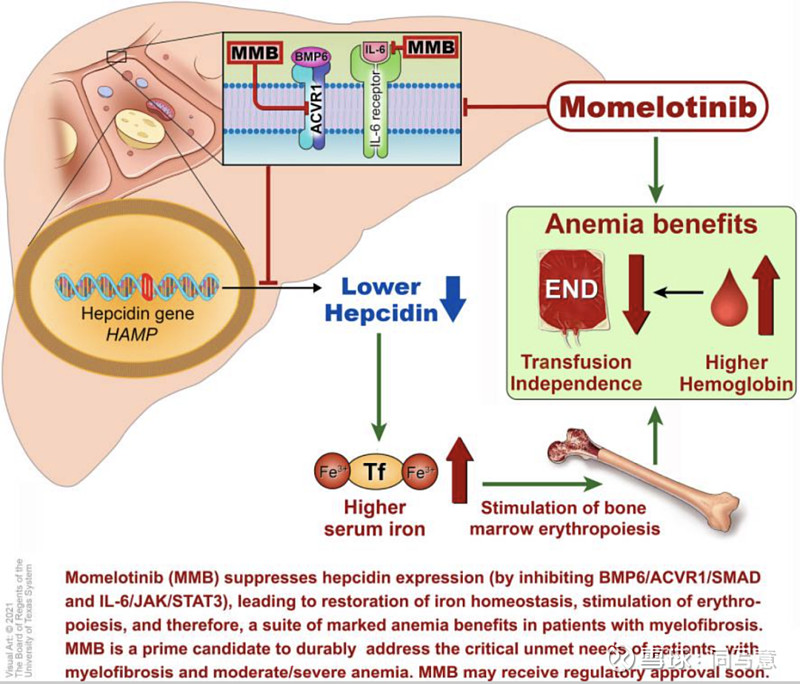
momelotinib具有贫血治疗益处
虽然统计学上的终点显示momelotinib不劣于达那唑,但结果显示其在贫血治疗上优于对方。这表明,momelotinib比现有的重磅炸弹Jakafi更具优势,因为后者或可能导致贫血。Sierra因此决心将贫血作为研发战略的重点。
Sierra将在今年的第二季度申请FDA批准,下半年向欧盟提交申请。如果进展顺利的话,momelotinib将于2023年初在美国获得批准,并在2023年上半年上市。
Sierra还计划启动一项II期研究,以评估momelotinib及新型BET抑制剂SRA515的联合研究。
03 独树一帜,挑战对手
在过去的几年,GSK加速回归肿瘤赛道,各种重金买弹药。目前该公司已经拥有15种潜在药物的开发组合,并在2019年,并与辉瑞一起成立了一家新的CHC合资企业,专注于其制药业务,尤其是肿瘤业务。
而此次GSK大手笔买入momelotinib,部分也是出于扩展其血液肿瘤管线的考虑。MF是一个小领域,但其中存在着巨大未满足的临床需求,而momelotinib可以提供差异化选择,弥补目前已上市产品的关键空白。
MF是一种进行性骨髓增殖性肿瘤,其患者的中位生存时间短,仅5.7年,高危患者仅2.3年,部分患者后期会发展为急性髓系白血病(AML)。
目前获得FDA批准的MF仅有两款,除了前述提及由Incyte/诺华开发的Jakafi(JAK1/JAK2抑制剂),另一款是BMS的Inrebic(JAK2抑制剂)。
作为首款获批的MF药物,Jakafi显著改善了患者生活质量,在脾脏肿大、全身症状(盗汗、低烧、骨痛等)方面具有显著的缓解作用,已成为全球护理标准。
Jakafi在2021年第四季度的销售额达到5.923亿美元,同期增长15%。据Incyte估计,Jakafi在2022年将会创造23-24亿美元收入。
但辉煌成绩的背后,Jakafi的缺点让人无法忽略。Jakafi在上市之初,便携带的血小板异常的黑框警告。
大约1/3的MF患者在诊断时存在贫血,而几乎所有患者最终都会出现贫血。贫血是MF患者疾病进展的主要因素,需要输血的贫血对患者和医疗保健系统而言都是巨大的负担。
由于骨髓抑制,Jakafi可能会加剧MF相关性贫血,在临床实践中,是导致Jakafi停用的主要原因,次要原因是Jakafi作用失效,比如脾脏反应丧失。
Inrebic成为第2款获批上市的MF治疗药物,于2019年8月在美国获批,用于治疗中2级和高危MF患者,为对Jakafi耐药或不耐受的患者提供了一个可行的选择。
Inrebic开发的坎坷程度不亚于momelotinib,2010年赛诺菲以5.6亿美元收购Inrebic,但随后因为试验中出现罕见的韦尼克脑病并发症,被FDA叫停,赛诺菲因此放弃开发Inrebic。Inrebic的发明人以低价收回了该药物,几经波折,当FDA重新开启Inrebic的试验后,Celgene(后被BMS收购)以总计70亿美元的价格对其进行收购。
Inrebic在2021年为BMS创造了7400万美元的收入,同期增长35%。但是,Inrebic同样会产生和Jakafi相似的骨髓抑制作用。
momelotinib的机制独树一帜,虽然与上述两款药物相比,其脾脏体积减少数据没有明显差异,但它对贫血的改善却显而易见,为MF患者提供差异化选择路径。更为重要的是,momelotinib可能对一线和二线的MF患者具有总体生存益处。
GSK引入momelotinib后,将其作为新药Blenrep搭档之一,日后持续在血液学领域发挥光热。Blenrep于2020年获批用于四线多发性骨髓瘤的治疗。
新药研发,九死一生。如果一切顺利,2024年是momelotinib首个完整收益年度。这款产品的出现究竟会为GSK带来什么样的未来,令人期待。
参考文献:
1.GSK inks $1.9B Sierra takeover as $3M bet on Gilead castoff turns into blockbuster buyout
2.GSK acquires Sierra Oncology, betting $2B on a bone cancer drug with a long history
3.GSK Acquires Sierra in $1.9B Complimentary Deal Aimed at Rare Cancers
4.Chifotides HT, Bose P, Verstovsek S. Momelotinib: an emerging treatment for myelofibrosis patients with anemia. J Hematol Oncol. 2022;15(1):7. Published 2022 Jan 19. doi:10.1186/s13045-021-01157-4
5.BTJ:JAK-STAT signaling pathway(II)
6.ASH 2014: Is it too late for Momelotinib?