撰文丨李杰,上海睿智副总裁
翻译丨同写意团队
默沙东的Molnupiravir(后文简称M药)激发了我们对小分子抗病毒药物作为对抗冠状病毒这一隐形敌人制胜武器的想象力。现在让我们深入研究最先进的小分子抗病毒药物的作用机制。在这里学到的知识可能会帮助我们理解抗病毒药物及一般药物设计。
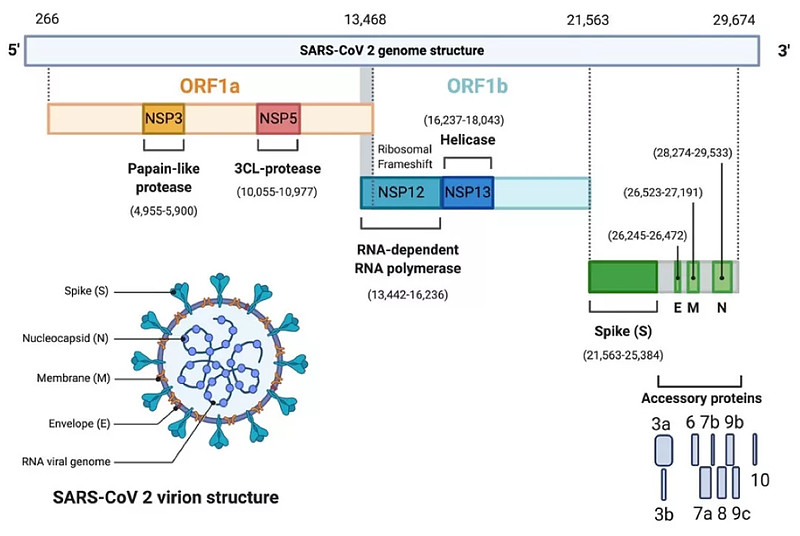
尽管冠状病毒对人类造成了种种危害,但病毒本身无法自我复制。它必须侵入正常细胞,借助正常细胞的生化机制进行复制,制造子病毒。
虽然每一种病毒都是独特的,但所有病毒的复制都遵循一个共同的生命周期。以RNA病毒为例,其利用宿主核糖体转化为自身的病毒结构和非结构蛋白。新冠病毒的mRNA编码的四种主要结构蛋白是刺突蛋白(S)、包膜蛋白(E)、膜蛋白(M)和核衣壳蛋白(N)。
此外,在RNA基因组中还有十几种非结构蛋白(NSPs)编码。目前最相关的分别是NSP-12和NSP-5。NSP-12是病毒RNA依赖的RNA聚合酶,NSP-5是主要的蛋白酶(Mpro),也称为3-糜蛋白酶样蛋白酶(3CLpro)。这两种酶是小分子抗病毒药物的主要靶标。
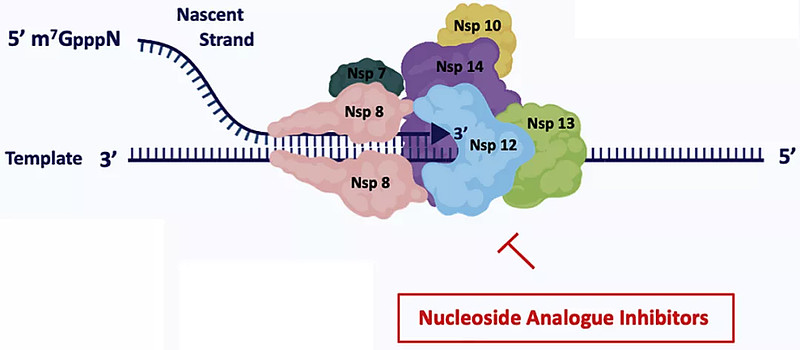
01 RNA依赖性RNA聚合酶抑制剂
罗氏的RO7496998(AT-527)是一种RNA依赖性RNA聚合酶抑制剂。另一方面,默沙东的M药充当天然核苷的替代物,潜入新合成的病毒RNA,引发大量突变,并快速破坏新合成的病毒RNA模板的蛋白质合成。这个过程被称为致命突变。
RNA依赖性RNA聚合酶(可能以NSP-7和-8为辅因子)的作用机制是催化病毒RNA的合成,并在冠状病毒的复制和转录周期中发挥核心作用。在病毒复制周期中,该酶具有双重作用:一是借助基因组模板转录mRNA;二是作为复制酶复制基因组RNA。
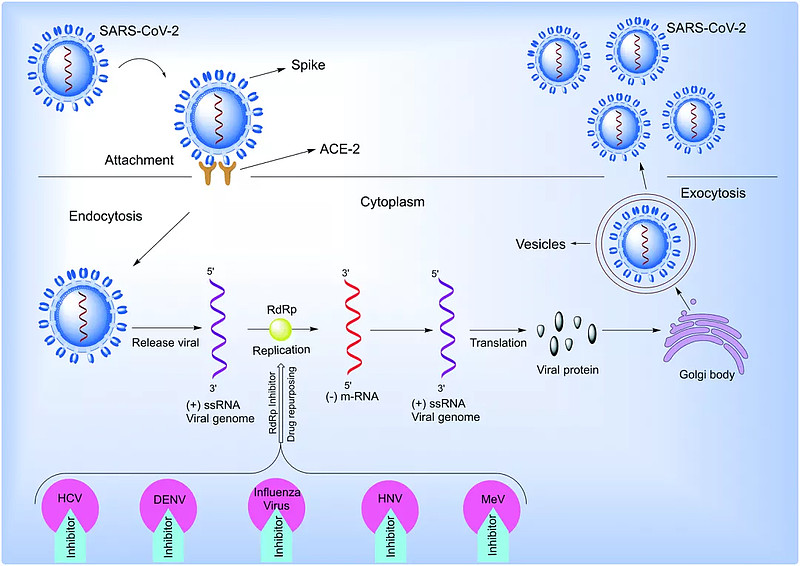
在进化的远端RNA病毒中,RNA依赖性RNA聚合酶的保守性以及宿主同源物的缺失显然使其成为药物再利用的理想靶点。因此,当病毒在人体细胞内复制而不损害健康细胞时,抗病毒药物才能对其进行靶向。但是也需要尽早使用抗病毒药物,以达到最好的疗效。
因此,已经探索了大量针对RNA依赖性RNA聚合酶的链终止剂或突变核苷类似物抑制剂。研究发现,腺嘌呤或鸟嘌呤衍生物形式的核苷类似物可阻断包括人类冠状病毒在内的广谱RNA病毒的基因合成。
这正是药物再利用对RNA依赖性RNA聚合酶抑制剂如此有效的原因,因为针对其他RNA病毒(如丙型肝炎病毒、流感病毒和登革热病毒)的药物可能对冠状病毒同样有效。
AT-527最初是波士顿的Atea制药公司开发的一种作为治疗丙型肝炎的抗病毒药物。现在它被用于治疗新冠。2020年11月,罗氏斥资3.5亿美元购买AT-527的专利权,这便是RO7496998。AT-527是一种鸟苷核苷酸类似物和一种与吉利德的瑞德西韦非常相似的protide前药,但AT-527是一种口服药。
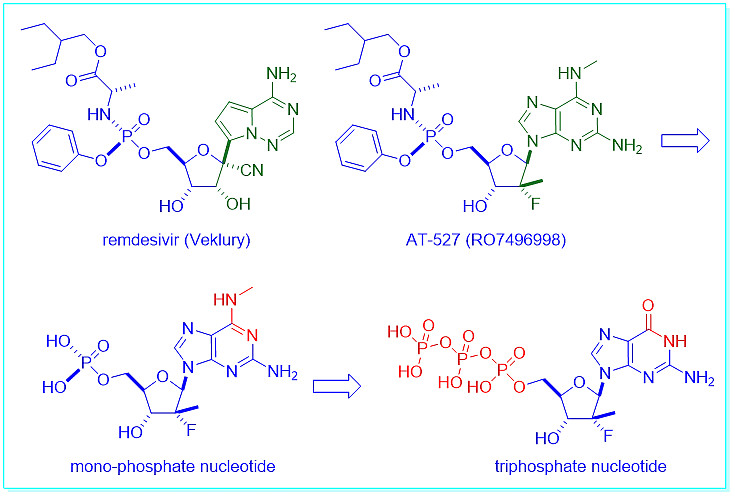
与瑞德西韦一样,AT-527是冠状病毒RNA依赖性RNA聚合酶的抑制剂。一旦进入体内,蛋白质前体药物水解为相应的单磷酸核苷酸,随后通过磷酸化反应成为相应的三磷酸核苷酸。三磷酸核苷酸是最终的活性药物,它是构建核苷酸的基础原料之一,包括尿苷(U)、腺苷(A)、胞苷(C)和鸟苷(G)。所以,AT-527是RNA合成的链终止剂。[1]
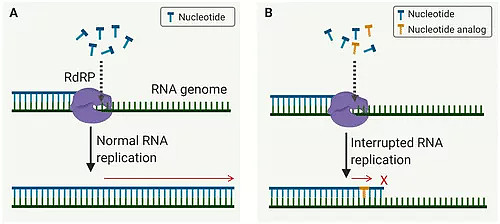
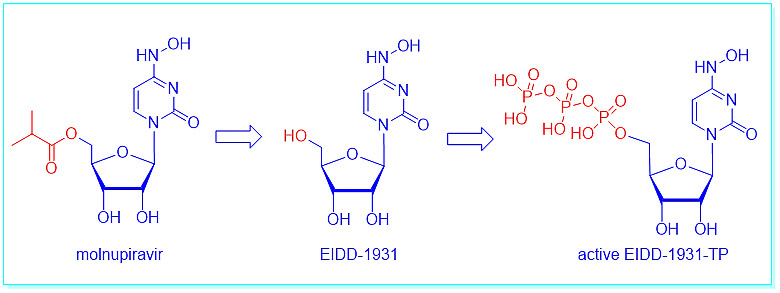
默沙东的M药的作用机制是基于所谓的病毒“错误灾难”。M药进入系统后,首先水解为EIDD-1931,然后转化为相应的EIDD-1931-三磷酸盐(TP)。EIDD-1931-TP才是真正有活性的药物,与AT-527TP不同,它是一种假的构建块,能与病毒RNA结合。在病毒RNA合成过程中加入EIDD-1931-TP会导致后面的碱基错误配对,导致高突变率和高致死率。
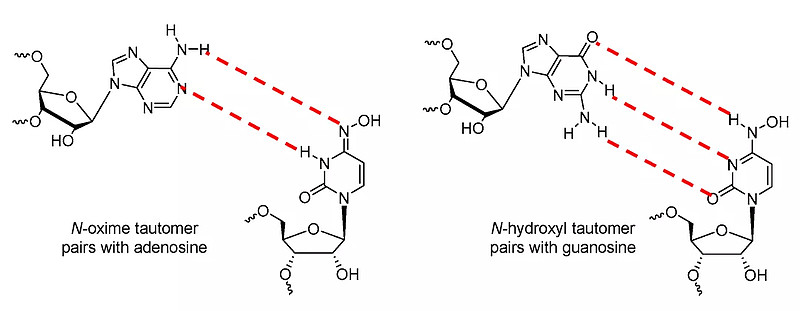
如下所示,EIDD-1931-TP以两种互变异构形式存在,已证明他们在水溶液中具有相似的能量。左边的N-肟互变异构体可以模拟A-U碱基对,而右边的N-羟胺互变异构体可以模拟C-G碱基对。
当病毒在掺入EIDD-1931-TP的情况下生长时,其RNA依赖性RNA聚合酶将EIDD-1931-TP读取为U而不是C,因此将A放在本应插入G的位置。这种误读导致病毒基因组的大量突变,并导致“病毒错误灾难”。最后,M药导致G-to-A和C-to-U转换突变频率增加。[2]
总之,M药破坏了新冠病毒基因组复制的保真度,并通过一个被称为“错误灾难”的过程积累错误来防止病毒传播。[3]
02 主要蛋白酶抑制剂
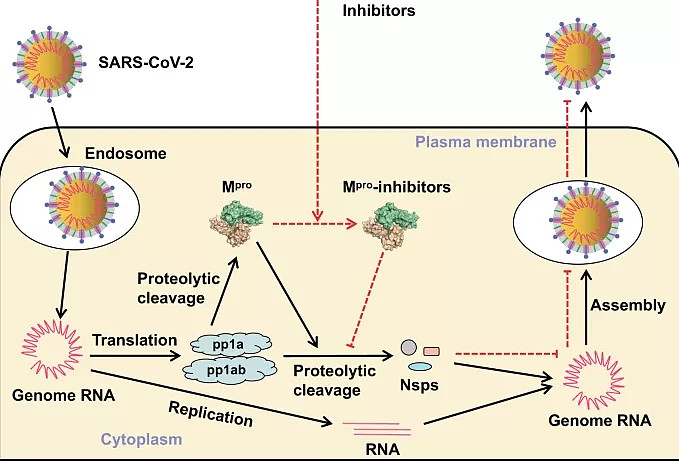
来自新冠病毒的RNA,编码一种称为多聚蛋白的大蛋白。病毒利用蛋白酶催化多聚蛋白的分解。这些蛋白酶像剪刀一样,将多聚蛋白切割为功能性非结构蛋白(NSPs),这些非结构蛋白随后可以成熟为病毒复制机制,制造新的病毒。
冠状病毒NSP5是主要蛋白酶(Mpro),也称为3CLpro。NSP5之所以被称为Mpro,是因为它能切割16个多蛋白中的11个。这是病毒生命周期中最早的步骤之一,能控制病毒的复制,因此被认为是一个主要的靶标,并为基于理性的抗病毒药物的发现提供了机会。
早在2003年,辉瑞就发现了一种Mpro抑制剂—PF-07304814,用于治疗严重急性呼吸综合征(SARS)。2020年9月,作为药物再利用计划的一部分,辉瑞将PF-07304814用于治疗新冠的临床试验。尽管它是一种磷酸盐前药,但口服生物利用度不高,必须静脉注射。
与此同时,辉瑞于2020年7月确定了口服临床候选药物PF-07321332,并于2021年2月开始了一期临床试验。如下图所示,它是一种可逆抑制剂,与主蛋白酶在145位的半胱氨酸(Cys145)形成共价键。
PF-07321332的口服生物利用度似乎较低,因为它是一种被称为CYP34A的肝酶的底物。这就是它必须与CYP34A抑制剂利托那韦合用的原因,这也是这种药的缺点。目前,2/3阶段的结果比较看好,辉瑞计划在2021年底申请该化合物的紧急使用授权。[4]
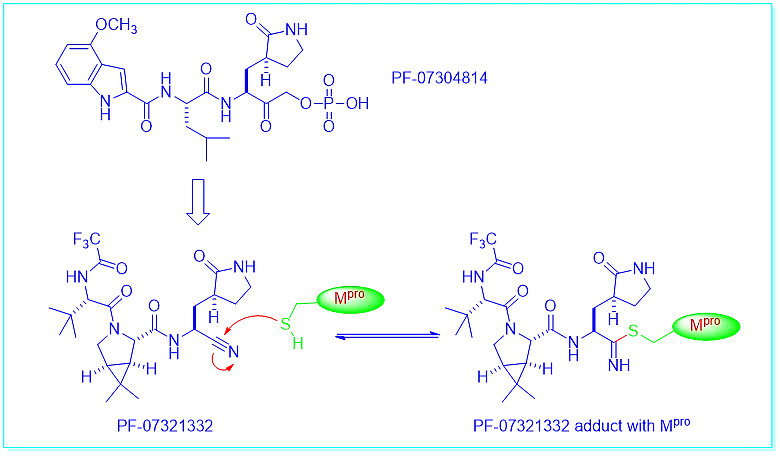
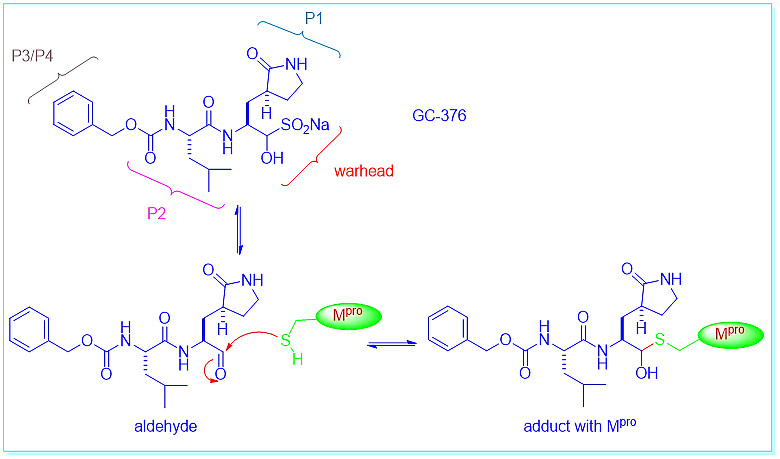
与PF-07321332一样,GC-376也是Mpro的可逆共价抑制剂。它最初于2012年在堪萨斯州立大学被发现。[5] Anivive Lifesciences将GC-376重新利用于新冠治疗。[6]
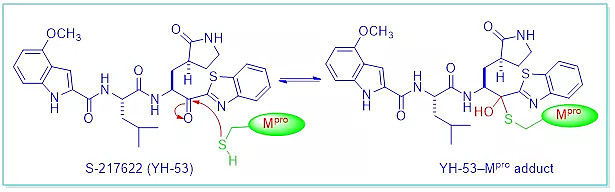
10月初,日本制药公司Shionogi宣布其名为S-217622的Mpro抑制剂的3期试验结果呈阳性。该药以芳基酮为弹头,与Cys415在Mpro上形成共价四面体加合物。7S-217622是一种口服药片,每天服用一次,连续服用五天。Shionogi计划在今年年底前将该药物提交给日本监管部门进行审批。
Pardes Biosciences发现了PBI-0451,一种Mpro抑制剂,也是一种可逆共价抑制剂。Enanta Pharmaceuticals的临床候选药物EDP-235是一种口服蛋白酶抑制剂。诺华正在研究蛋白酶抑制剂,但目前仍处于临床前阶段。
Pardes和Enanta临床候选药物的结构尚未披露。
随着多种安全高效疫苗的陆续出现、以及多种口服抗病毒药物的研制成功,我们终将战胜“看不见的敌人”——新冠疫情。
希望胜利快点到来!