近日,FDA宣布批准赛诺菲(Sanofi)公司开发的CD38抗体Sarclisa(isatuximab-irfc)上市,与泊马度胺(pomalidomide)和地塞米松(dexamethasone)联用,治疗成年多发性骨髓瘤(RRMM)患者。
多发性骨髓瘤(MM)是一种血液癌症,由于骨髓中的抗感染浆细胞癌变产生异常蛋白质,并从骨髓中排出感染其他健康的血细胞。最常见于65-74岁的人群。美国国家癌症研究所(National Cancer Institute)估计,到2020年,美国将有32,270例多发性骨髓瘤新病例和12,830例相关死亡。在我国,多发性骨髓瘤的发病率已超过急性白血病,约为十万分之一。
Sarclisa是一种靶向CD38的溶细胞抗体,通过静脉输注给药。其活性药物成分isatuximab是一种IgG1嵌合单克隆抗体,靶向浆细胞CD38受体的特定表位,能够触发多种独特的作用机制,包括促进程序性肿瘤细胞死亡(凋亡)和免疫调节活性。
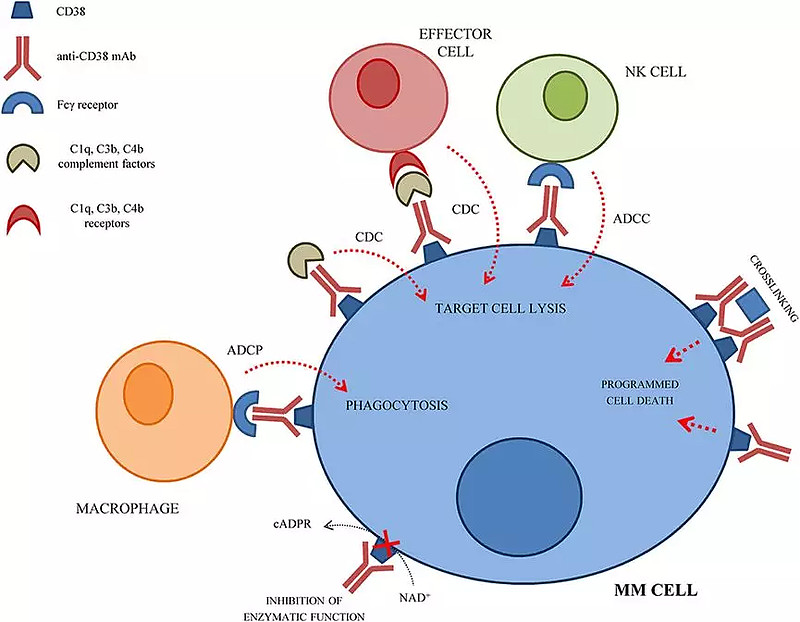
(抗CD38mAb对MM细胞的作用机制示意图)
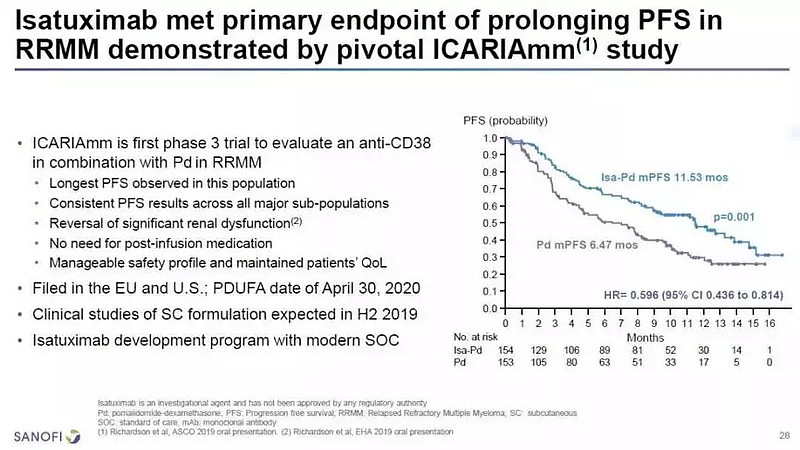
FDA基于关键性III期ICARIA-MM研究的数据批准Sarclisa上市,该临床试验纳入分析了307例复发性和难治性多发性骨髓瘤患者。此前,这些患者至少接受过2个连续周期的来那度胺和蛋白酶体抑制剂单独或联合治疗。
其中一半的患者接受Sarclisa联合泊马度胺(Pomalyst)和小剂量的地塞米松治疗,另一半患者仅接受马度胺和小剂量的地塞米松(pom-dex)治疗。研究数据显示:Sarclisa联合疗法,无进展生存期(PFS)的统计显著改善,中位PFS为11.53个月,而单独使用pom-dex则为6.47个月(HR 0.596, 95%CI:0.44-0.81,p = 0.0010),疾病进展或死亡风险降低40%。与单独使用pom-dex相比,Sarclisa联合疗法还显示出明显更高的总体缓解率(60.4%对35.3%,p <0.0001)。
在产品布局方面,赛诺菲还启动了多项临床试验,检验isatuximab与不同类型的标准疗法联用,治疗处于疾病不同阶段的MM患者的疗效。
CD38抗体赛道热闹非凡
强生的Darzalex(daratumumab)是全球首个上市的靶向CD38的单抗药物。在代号为SIRIUS的临床研究中,daratumumab实现了65%的一年总生存率,在双重耐药多发性骨髓瘤患者中取得了30%的客观应答率。作为强生的重磅产品,Darzalex早在2015年便开始布局多发性骨髓瘤患者的四线药物,稳扎稳打,一步步扩展适应症,升级成临床一线用药。
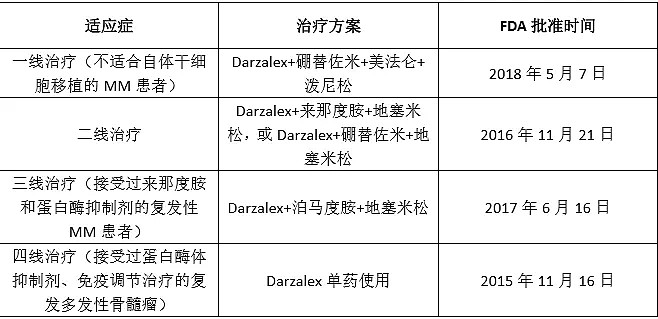
(强生Darzalex获批的适应症)
前不久,天境生物宣布,用于多发性骨髓瘤(MM)的创新人源CD38抗体TJ202/MOR202于中国医学科学院血液研究所完成中国大陆地区多中心注册临床II期试验的首例患者给药。
2019年4月,CASI 制药公司(英创远达)宣布从Black Belt Therapeutics公司引进一款新型CD38单克隆抗体TSK011010,并获得了全球独家权利。
2018年,Molecular Templates宣布与武田(Takeda)达成合作协议,共同研发靶向糖蛋白CD38的工程化毒素体(Engineered Toxin Bodies,ETBs),以期应用于治疗包括多发性骨髓瘤(Multiple Myeloma)在内的多种疾病。此外,罗氏通过收购Tusk Therapeutics也获得了一款正处于早期开发阶段CD38抗体候选药。
结语
MM目前仍是临床上非常棘手的问题,充满挑战。以isatuximab为代表的CD38单抗类药物为基础的单药或联合方案,未来可以探索的方向还有很多,在经过大量临床研究验证后,期待给更多的患者带来临床获益。
参考资料:
[1] FDAApproves New Therapy for Patients with Previously Treated Multiple Myeloma网页链接
[2] 强生重磅品种Darzalex完美升级,获批一线治疗多发性骨髓瘤网页链接 a grueling 10-year drought, Sanofi finally wins an OK for an in-housecancer drug网页链接
